| Resumen de contenidos: | Habilidades a desarrollar: |
| o Virus o Bacterias o El sistema inmune o Inmunidad innata y adaptativa o Componentes de la inmunidad innata o Inmunidad adaptativa, humoral y celular o La respuesta inmune | o Informarse en distintas fuentes o Interpretar gráficos, tablas y fotografías, y construir modelos conceptuales o Razonar, inferir y hacer conjeturas en base a conocimientos previos y problemas o Experimentar y controlar variables |
1. Virus
Los virus poseen unidad y diversidad estructural
Un virus es un agente genético que posee un ácido nucleico que puede ser ADN o ARN, rodeado de una envoltura de proteína llamada cápside. Algunos virus también están rodeados por una envoltura membranosa externa que contiene proteínas, lípidos, carbohidratos y vestigios de metales. Un virus pequeño típicos, como el de la poliomielitis (poliovirus), mide unos 20 nm (nanómetros) de diámetro, que es el tamaño aproximado de un ribosoma, mientras que un virus grande, como el de la viruela (poxvirus), puede llegar a medir 400 nm de largo y 200 nm de ancho.
|

Dado que no pueden ser considerados seres vivos, los virus no se clasifican en las categorías taxonómicas clásicas ni se les nombra mediante nomenclatura binominal. Cuando se les clasifica, se suelen utilizar como criterios el tipo de ácido nucleico que poseen y la estructura de la cápside, tal como se muestra en la figura 2.
Figura 2: Algunas categorías de virus
En términos más funcionales, los virus pueden actuar de dos formas distintas:
- Reproduciéndose en el interior de la célula infectada, utilizando todo el material y la maquinaria de la célula hospedante.
- Uniéndose al material genético de la célula en la que se aloja, produciendo cambios genéticos en ella.
Por eso se pueden considerar los virus como agentes infecciosos productores de enfermedades o como agentes genéticos que alteran el material el material hereditario de la célula huésped.
Los virus se reproducen como parásitos obligados
Como ya se dijo, la única función que poseen los virus y que comparten con el resto de los seres vivos es la de reproducirse o generar copias de sí mismos, necesitando utilizar la materia, la energía y la maquinaria de la célula huésped, por lo que se les denomina parásitos obligados.
Los virus una vez infectan a una célula, pueden desarrollar dos tipos de comportamiento, bien como agentes infecciosos produciendo la lisis o muerte de la célula o bien como virus atenuados, que añaden material genético a la célula hospedante y por lo tanto resultan agentes de la variabilidad genética.
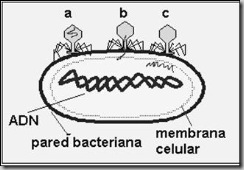
Ambos casos han sido estudiados con detalle en los virus bacteriófagos, y aquí puedes ver en unos dibujos esquemáticos en la figura 3a .
|
En los dos casos de infección el proceso empieza de esta forma:
a) Fase de fijación: Los virus se unen por la placa basal a la cubierta de la pared bacteriana.
b) Fase de contracción: La cola se contrae y el ácido nucleico del virus se empieza a inyectar.
c) Fase de penetración: El ácido nucleico del virus penetra en el citoplasma de la bacteria, y a partir de este momento puede seguir dos ciclos diferentes:
3b
En el ciclo lítico el ADN bacteriano fabrica las proteínas víricas y copias de ácidos nucleicos víricos. Cuando hay suficiente cantidad de estas moléculas, se produce el ensamblaje de la proteína y el ácido nucleico vírico y se liberan al medio, produciendo la muerte de la célula (figura 3b-c)
|
El virus queda en forma de profago. (figura 3b-d)
|
Figura 3c (izquierda): Etapas del ciclo lítico. Figura 3d (abajo) Etapas del ciclo lisogénico. |
Figura 6. Ciclo lítico de virus de ADN
Figura 6. Ciclos lítico de virus de ARN o retrovirus ( abajo )
2. Bacterias
Las bacterias son microorganismos procariotas de organización muy sencilla
Si bien la célula bacteriana carece de la mayoría de las estructuras típicas de una célula eucarionte, mantiene varios puntos de coincidencia estructural y funcional.
El citoplasma presenta un aspecto viscoso, y en su zona central aparece un nucleoide que contiene la mayor parte del ADN bacteriano. No está rodeado por membrana, es circular y de doble hebra como el ADN eucarionte. Para tener una idea del tamaño de este ADN, Escherichia coli posee 4 millones de pares de bases, que representan alrededor de 4 mil genes (en un ser humano, los genes se calculan en 30 mil aproximadamente). Todo esto es una estructura que ocupa cerca del 10% del volumen total de la bacteria y que linealmente mide 1 mm. de largo (poco más de 1 metro en seres humanos). Cabe señalar que en bacterias, los procesos de transcripción y traducción son similares a los de eucariontes.
En algunas bacterias, aparecen fragmentos circulares de ADN con información genética dispersos por el citoplasma: los plásmidos o plasmidios, los mismos que son utilizados en la técnica del ADN recombinante.
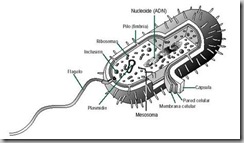
| Figura 7. Estructura de una bacteria. La cápsula, fimbrias, flagelo y plasmidios, no siempre están presentes en todos los tipos de bacterias |
La membrana plasmática presenta invaginaciones, que son los mesosomas, donde se encuentran enzimas que intervienen en la síntesis de ATP y los pigmentos fotosintéticos en el caso de bacterias fotosintéticas, de manera análoga a las crestas mitocondriales y los tilacoides plastidiales, respectivamente. En el citoplasma se encuentran inclusiones de diversa naturaleza química.
Muchas bacterias pueden presentar flagelos generalmente rígidos, implantados en la membrana mediante un corpúsculo basal. Pueden poseer también, fimbrias o pili muy numerosos y cortos, que pueden servir como conductos de intercambio de ADN de una célula a otra.
Poseen ARN y ribosomas característicos, para la síntesis de proteínas.
La pared celular bacteriana, al igual que la pared de la célula vegetal, queda por fuera de la membrana plasmática. Es rígida y está formada normalmente por una molécula compleja llamada peptidoglicán. Es una estructura fuerte que ha evolucionado para contrarrestar la gran presión osmótica que se genera en el citoplasma por el alto contenido de solutos. Esta presión llega a ser de varias atmósferas. En Escherichia coli se estima que llega a 2 atmósferas y en otras bacterias alcanza a 8 atmósferas (¡50 veces la presión con que sale la sangre desde el corazón!). Por lo tanto, la función de la pared celular es prevenir la lisis de la bacteria. Además, la pared celular es la responsable tanto de la forma de la bacteria como de su designación de carácter taxonómico: Gram positivo / Gram negativo. Las bacterias Gram + poseen una capa de peptidoglicán grueso, mientras que las Gram – presentan una capa más delgada cubierta por una membrana plasmática externa, similar a la bicapa lipídica clásica.
Como las bacterias desprovistas de la pared celular no pueden vivir, algunos antibióticos, tales como la penicilina y sus derivados, tienen como blanco inhibir enzimas necesarias para fabricar la pared celular. También, la enzima lisosima presente en las lágrimas, es capaz de digerir el peptidoglicán de la pared celular bacteriana y
así ayuda a prevenir la entrada de las bacterias al organismo. Esta enzima es parte de la primera línea de defensa del organismo contra las infecciones bacterianas del ojo.
Por fuera de la pared, algunas bacterias poseen una cápsula (no confundir con la cápside viral), la que se relaciona con la resistencia a la fagocitosis por parte de células de defensa del organismo infectado.
Variedad de formas de bacterias
| Figura 8. Variedad de formas de bacterias |
A partir de esta estructura básica, existe una gran diversidad de bacterias, en cuanto a forma, tamaño, metabolismo, hábitat, modo de vida, etc.
| Figura 9. Algunos tipos representativos de bacterias | ||
| Staphylococcus | Vibrio | Cianobacteria |
Las bacterias se reproducen asexualmente, mediante fisión binaria
| Figura 10. Fisión binaria en una bacteria |
Las bacterias se reproducen en forma asexual, por lo común mediante fisión binaria, mecanismo también conocido como bipartición. Este proceso consiste en que una célula madre da origen a dos células genéticamente idénticas, pero de menor tamaño. Primero se duplica el ADN bacteriano circular con ayuda de ADN polimerasa, y después se forma una pared transversal por crecimiento interno de la membrana plasmática y la pared celular, tal como se muestra en la figura 10 y 11.
Algunas especies de bacterias, tras dividirse, mantienen a las células hijas unidas a través de las membranas. Esta característica permite formar colonias bacterianas, que facilitan mucho su identificación, pues cada especie que forma estas agrupaciones, lo hace de una forma especial: en una sola hilera unidimensional (como Staphylococcus de la página anterior), en dos dimensiones, en racimos, etc.
La fisión binaria ocurre muy rápido. En condiciones ideales, algunas bacterias se dividen a intervalos de 20 minutos. A ese ritmo, si no hay interferencia, una bacteria daría origen a más de mil millones de bacterias en 10 horas. Sin embargo, las bacterias no pueden reproducirse a esta rapidez durante mucho tiempo, porque pronto la falta de alimento o la acumulación de productos de desecho lo impedirían.
Otros mecanismos reproductivos que utilizan las bacterias con gemación y fragmentación, igualmente asexuales.
Otros mecanismos reproductivos que utilizan las bacterias son gemación y fragmentación, igualmente asexuales
Las bacterias son capaces de generar variabilidad mediante mecanismos de transferencia génica.
La transferencia génica se refiere al movimiento de la información genética entre los organismos. En eucariontes esto ocurre generalmente por reproducción sexual. En bacterias existen tres mecanismos de transferencia de genes: transformación, transducción y conjugación, ninguno de los cuales involucra la reproducción sexual.
La importancia de la transferencia génica se debe a que aumenta enormemente la diversidad genética entre organismos. Si bien las mutaciones dan cuenta de cierta diversidad, la mayor parte de la diversidad genética en bacterias proviene de la transferencia génica. Tal diversidad es vital para explicar de qué manera las bacterias han sido capaces de evolucionar a través del tiempo. Los organismos con genes que les permiten adaptarse a un ambiente determinado sobreviven y se reproducen mientras que los que no tienen esos genes, mueren. Si todos los organismos fueran genéticamente idénticos, todos sobrevivirían y se reproducirían, o todos perecerían.
a) Transformación:
Según este mecanismo, las bacterias tienen la capacidad para incorporar ADN desde el medio ambiente, que en la naturaleza proviene de bacterias destruidas. Como ya se ha visto, esta propiedad se utiliza en el laboratorio para clonar genes que previamente son introducidos en plasmidios (Griffith, 1928).
b) Conjugación:
El material genético se transfiere de una bacteria a otra por un proceso que requiere el contacto entre el donador y el aceptor y pueden pasar mayores cantidades de ADN que en la transformación. De hecho, puede traspasarse hasta un cromosoma entero.
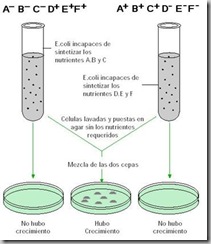
| Figura 12. ( arriba ) Experimento de Lederberg que demostró mecanismo de conjugación |
Fue descubierta en 1946 por Joshua Lederberg cuando aún era estudiante de medicina. En sus experimentos, utilizó cepas mutantes de E. coli, que eran incapaces de sintetizar ciertas substancias. Eligió dos cepas con defectos en vías metabólicas distintas y las cultivó en medios de cultivo que carecían de la sustancia importante para el crecimiento de cada cepa. Las bacterias no crecieron. Pero observó que al ponerlas juntas eran capaces de crecer en el medio que carecía de los nutrientes. Ver figura 12.
El fenómeno se explica por un traspaso de información genética de una cepa a otra, que por esto adquiere la capacidad de sintetizar los nutrientes requeridos para su crecimiento. Esta propiedad se transmite a las generaciones siguientes. El mecanismo involucra el paso de plasmidio de una bacteria a otra por intermedio de un tubo que las interconecta. Ver figura 13.
Cabe recordar que en los plasmidios se encuentran genes de resistencia a antibióticos y de virulencia que pueden ser traspasados de una bacteria a otra.
Fig 13 .Proceso de congugación
c) Transducción:
Corresponde al mecanismo mediante el cual un virus fago transfiere genes bacterianos de una bacteria a otra, a través del proceso replicativo del virus.
Las bacterias desempeñan muchas funciones importantes para otras formas de vida
Las bacterias son capaces de colonizar hábitats tan diversos, en parte porque son capaces de usar una amplia variedad de fuentes de alimento. Las algas verdi-azules (que en realidad, son bacterias) participan en una fotosíntesis parecida a la que realizan las plantas. Otras bacterias, las quimiosintéticas, obtienen energía a través de reacciones que combinan el oxígeno con moléculas inorgánicas como el azufre, el amoniaco o los nitritos. En este proceso, liberan en la tierra sulfatos o nitratos, nutrientes esenciales para las plantas. Muchas bacterias, llamadas anaerobias, no dependen del oxígeno para extraer la energía. Algunas, como las bacterias que causan el tétanos, se envenenan con el oxígeno. Otras son oportunistas, participando en la fermentación cuando falta oxígeno y cambian a la respiración celular (proceso más eficiente) cuando hay oxígeno disponible. Anaerobios como las bacterias de azufre obtienen energía de un tipo exclusivo de fotosíntesis bacteriana. Usan el sulfuro de hidrógeno (H2S) en lugar del agua (H20) para la fotosíntesis, y liberan azufre en lugar de oxígeno.
Algunas bacterias tienen la propiedad poco común de romper la celulosa, componente principal de las paredes celulares de las lanzas. Algunas de éstas han entrado en una relación simbiótica literalmente "vivir juntos") con un grupo de mamíferos llamados rumiantes. Las bacterias viven en los tractos digestivos de los rumiantes y ayudan a liberar los nutrientes de los forrajes vegetales que el animal no puede separar por sí mismo. Las bacterias simbióticas también habitan los intestinos de los seres humanos. Estas se alimentan de los alimentos no digeridos y sintetizan nutrimentos como las vitaminas K y B12, que absorbe el cuerpo.
Otra forma de simbiosis bacteriana de enorme importancia ecológica y económica es el crecimiento de las bacterias que fijan nitrógeno en nódulos especializados de las raíces de algunas plantas, como las legumbres. Estas bacterias captan el gas nitrógeno (N2, que la tanta no puede utilizar en forma directa) del aire atrapado en el suelo y lo combinan con hidrógeno para producir amoniaco NH4+), un nutrimento importante para las plantas. Las bacterias también son importantes en la producción de alimentos para seres humanos, como el queso, el yoghurt y la salsa de soya. El envejecimiento de la carne lo suavizan empleando una digestión bacteriana controlada.
Las bacterias en su mayor parte son heterotróficas, obtienen energía al desdoblar moléculas orgánicas complejas (que contienen carbono), la cantidad de compuestos que son atacados por las bacterias es asombroso. Casi cualquier cosa que los seres humanos puedan sintetizar -incluyendo a los detergentes y el benceno, solvente venenoso- puede ser destruido por las bacterias. La expresión biodegradable (que significa "desdoblada por seres vivientes") se refiere en general al trabajo de las bacterias. Aun el petróleo es biodegradable. Poco después de que un barco petrolero vació 11 millones de galones de petróleo en el Brazo de Mar Príncipe William, en Alaska, los investigadores de la Exxon rociaron las playas, bañadas en petróleo, con un fertilizante que favorece el crecimiento
de las poblaciones naturales de las bacterias que consumen petróleo. Dentro de los 15 días siguientes, los depósitos de petróleo se habían reducido de manera notoria en comparación con las zonas no rociadas.
El apetito de algunas bacterias por casi cualquier compuesto orgánico es la clave de su labor trascendental de descomposición dentro de los ecosistemas. Mientras se alimentan a sí mismas, las bacterias descomponen productos de desecho y cuerpos muertos de plantas y animales, liberando nutrimentos para usarse otra ver y permitir así, su reciclado, lo cual da la base para la continuación de la vida en la Tierra.
3. El Sistema Inmune
La comprensión de la organización y funcionamiento del sistema inmune ha sido el producto de muchos años de investigación científica (texto complementario de referencia)
El concepto de enfermedad imperante durante los siglos XVII y XVIII establecía que los hombres y animales nacían trayendo consigo las semillas u óvulos de las diferentes enfermedades. Cada una de estas semillas podría luego ser fecundada y producir la enfermedad. Ya que estas semillas serían únicas, una vez que una determinada enfermedad se presentara ésta no volvería a aparecer. Con esto entonces, se daba una explicación plausible a la inmunidad adquirida. Sería a partir de 1870 y gracias al trabajo de Louis Pasteur, Robert Koch y otros destacados científicos que se logró la identificación de los agentes infecciosos y la elucidación de sus mecanismos de acción.
Los nuevos conceptos de patogénesis de las enfermedades y en especial la demostración de Pasteur de que la inmunidad adquirida contra la tóxina del cólera podría ser inducida inmunizando con cepas atenuadas de los patógenos dieron un gran impulso al avance de la Inmunología. En 1880, Louis Pasteur en colaboración con Emile Roux descubrieron variaciones en la patogenicidad de diferentes cepas de un determinado microorganismo y algunas de estas cepas producían enfermedades menos severas que otras. Estos investigadores diseñaron técnicas para la atenuación de cultivos de bacterias virulentas que producen la enfermedad del cólera en aves, encontrando que pollos que se han recuperado de un ataque de cólera inducido por una cepa atenuada eran protegidos de una nueva infección con cepas más letales. Este trabajo, que estuvo basado sobre las investigaciones de Edward Jenner sobre la vacunación contra la viruela, abrió un nuevo campo de investigación sobre la inmunización preventiva. Posteriormente, Pasteur realizaría similares trabajos investigando el antrax, la rabia y otras enfermedades infecciosas.
En 1888 Emile Roux y Alexandre Yersin demostraron que una toxina soluble podía ser aislada desde los sobrenadantes de cultivos del microorganismo de la difteria. Ellos encontraron que la toxina por sí sola producía en animales experimentales los mismos síntomas que la enfermedad, lo que significaba que en algunos casos no era el microorganismo en sí sino que una exotoxina producida por el patógeno la responsable de la difteria. Dos años después, von Behring y Kitasato observaron que animales inmunizados con toxinas del tétano y de la difteria producían algo en su sangre capaz de neutralizar y destruir la toxina previniendo la enfermedad. Estos científicos utilizaron suero de estos animales inmunizados en niños infectados logrando una significativa mejoría y cura, especialmente cuando el suero era utilizado en etapas tempranas de la enfermedad. La substancia capaz de combatir a la toxina fue llamada antikörper (anticuerpo) y el material responsable de generar estos anticuerpos se conocieron como antígenos. Los hallazgos de von Behring abrieron un nuevo campo de investigación para el tratamiento de nuevas enfermedades conocido como seroterapia y von Behring recibió el Premio Nobel de Medicina en 1901.
Con la demostración de que la inmunidad puede ser transferida pasivamente a través del suero quedó claro que los anticuerpos correspondían a sustancias que debían formarse en el cuerpo de la persona inmunizada. Una de las teorías que surgieron proponía que el antígeno llevaba la información necesaria para reaccionar específicamente con una molécula de anticuerpo. Sin embargo, esta hipótesis fue rápidamente descartada al observar que se producía una mayor cantidad de anticuerpos que la cantidad de antígeno inyectada. Paul Ehrlich propuso en 1897 que los anticuerpos eran macromoléculas que se complementaban con la estructura de los antígenos en una forma específica y que funcionaban como receptores en la superficie de las células. Ehrlich postuló que estos receptores serían seleccionados para un antígeno específico conduciendo a su pérdida lo que estimularía la sobreproducción compensatoria de receptores que aparecerían en la sangre como anticuerpos circulantes. Por esta teoría, la que influyó por décadas el estudio de la Inmunología, y por sus importantes trabajos en el tratamiento químico de enfermedades como la tripanosomiasis y la sífilis, Paul Ehrlich recibió el Premio Nobel de Medicina en 1908.
Una nueva e interesante observación en el campo de la Inmunología fue realizada por Jules Bordet en 1899. Bordet encontró que anticuerpos específicos para eritrocitos en conjunto con otro factor del suero no específico llamado complemento podían causar la destrucción de los eritrocitos (hemólisis). Además, él encontró que los componentes de esta reacción podían ser precisamente cuantificados (titulación) con lo cual se abrió una nueva aproximación en el diagnóstico de las enfermedades. Desde ese momento la sangre de un paciente podía ser examinada para la presencia de ciertos anticuerpos con lo cual ahora una determinada enfermedad podía ser seguida serológicamente. Bordet recibió el Premio Nobel de Medicina en 1919. Estos hallazgos fueron utilizados por August von Wassermann y sus colegas para crear un test de diagnóstico contra la sífilis basado en reacciones de antígeno y anticuerpo. Las anteriores observaciones sobre anticuerpos dirigidos contra eritrocitos capaces de producir aglutinación y hemólisis llevaron a Karl Landsteiner a proponer que los seres humanos podían ser divididos en varios grupos dependiendo de la presenciade aglutininas específicas para los eritrocitos de otros humanos. Esta clasificación sería la base para el actual sistema ABO de grupos sanguíneos.
| Fig. 14. Paul Ehrlich (1854 – 1915) |
Los historiadores de las ciencias reconocen que las eras en las que mayor avance se ha logrado en un determinado campo del conocimiento corresponden a aquellas épocas en las cuales se ha generado una disputa entre dos escuelas de pensamiento. En los primeros años de la Inmunología esto ocurrió entre los que defendían la teoría celular de la inmunidad y aquellos que proponían que toda la inmunidad estaba basada en la acción de los elementos humorales (anticuerpos). El máximo defensor de la teoría humoral fue Paul Ehrlich mientras que la teoría celular fue propuesta por el ruso Ilya Metchnikoff. Metchnikoff fue el primero en postular que los leucocitos podían cumplir un importante papel en la defensa del cuerpo contra las enfermedades infecciosas en virtud de sus capacidades fagocíticas. Metchnikoff se graduó de Biólogo y en 1865 descubrió la digestión intracelular en invertebrados hecho que posteriormente influiría notablemente en sus observaciones en el campo de la Inmunología. Durante su trabajo en embriología comparada, Metchnikoff observó que dentro de las larvas de estrella de mar existían células móviles las cuales propuso podrían de alguna manera participar en la defensa del cuerpo. Para comprobar su idea, Metchnikoff introdujo en las larvas una pequeña espina proveniente del árbol de Navidad que él había preparado para su hijo. Al día siguiente, observó que la espina estaba rodeada por células móviles. Como ya era conocido que cuando en animales que poseen un sistema vascular ocurre una inflamación se produce una movilización de leucocitos dentro de los vasos sanguíneos, Metchnikoff postuló que los leucocitos podían ingerir y digerir bacterias infecciosas tal y como él había observado durante sus estudios iniciales de digestión intracelular en invertebrados. Como una prueba adicional a su teoría, Metchnikoff describió que las esporas de hongos presentes en pequeños crustáceos eran atacadas por los fagocitos del crustáceo. Sin embargo, sus teorías encontraron una fuerte oposición entre los patólogos los que consideraban que los macrófagos que acompañaban la inflamación provocaban un daño mayor y no tenían un efecto protector. De hecho, en ese tiempo se postulaba que las células fagocíticas si bien podían ingerir a los patógenos éstos no eran destruidos sino que al contrario eran transportados por todo el cuerpo siendo la causa de la diseminación de la enfermedad. A pesar de esta oposición Metchnikoff continuó con sus experimentos y demostró que un exudado peritoneal rico en macrófagos activados era capaz de proteger a otro huésped frente a la inyección peritoneal de una dosis letal de diferentes bacterias patógenas. Este experimento correspondería al primer uso de lo que en la actualidad se conoce como inmunoterapia no-específica. En 1908 y como un intento por conciliar las posturas celular y humoral de la inmunidad se les otorgó a Paul Ehrlich y a Elie Metchnikoff el Premio Nobel de Medicina. Posteriormente, quedaría claro que estas dos teorías son los componentes fundamentales de la respuesta inmune.
Actividad
Las siguientes afirmaciones intentan registrar si lograste una lectura comprensiva del texto acerca de los comienzos de la inmunología. Márcalas si crees que son correctas. Procura hacerlo sin releer el texto.
a) _____ Inmunización preventiva es una reacción normal frente a los antígenos de enfermedades
b) _____ El contacto con un antígeno estimula la formación de anticuerpos
c) _____ Un antígeno puede ser una partícula de polvo
d) _____ La respuesta inmune ocurre mediante anticuerpos y no en base a los glóbulos blancos
e) _____ Los anticuerpos son células especializadas en la defensa del organismo
f) _____ Todos los anticuerpos poseen funciones relativas a la defensa inmune
g) _____ La inmunología es una ciencia que ha requerido el trabajo complementario de muchos científicos
El respuesta inmune es un sistema de defensa interno
Los animales tienen mecanismos de defensa interna que los protegen contra organismos causantes de enfermedad que ingresan en el cuerpo en aire, alimento y agua y a través de lesiones en la piel. Entre los microorganismos que causan enfermedades (denominados patógenos) se incluyen virus, bacterias, hongos y protozoarios. La defensa interna depende de la capacidad de un organismo de distinguir entre lo propio y lo ajeno. Tal reconocimiento es posible porque los organismos son bioquímicamente únicos. Las células tienen proteínas de superficie que difieren de las propias de las células de otra especie o incluso de las de otros miembros de la misma especie. Un animal reconoce sus propias células e identifica como ajenas las de otros animales.
Los agentes patógenos producen macromoléculas que el cuerpo reconoce como ajenas (o extrañas). Una sola bacteria puede tener de 10 a más de 1000 macromoléculas distintas en su superficie. También es posible que los patógenos secreten macromoléculas, algunas de las cuales son tóxicas para la mayor parte de los organismos. Cuando un patógeno invade a un animal, sus macromoléculas características estimulan los mecanismos de defensa del animal.
El término inmune proviene de una palabra latina que significa “seguro” o “a salvo”. La inmunología, que es el estudio de los mecanismos de defensa interna, es uno de los campos de investigación biomédica en más rápido cambio y más fascinantes de la actualidad. Una reacción inmunitaria o inmunorreacción implica el reconocimiento de macromoléculas extrañas y una reacción (o respuesta) encaminada a eliminarlas. Las inmunorreacciones dependen de la comunicación entre células, o señalización celular. Como se estudió en capítulos previos, un aspecto importante de la señalización celular es la transducción de señales, o sea la conversión de una señal extracelular en una serie de procesos intracelulares.
Los dos tipos principales de inmunorreacciones son las inespecíficas y las específicas. Los mecanismos de defensa inespecíficos, también llamados inmunorreacciones innatas, dan protección general contra los patógenos. Estos mecanismos impiden la entrada de la mayor parte de los agentes patógenos al organismo, y rápidamente destruyen los que llegan a superar las defensas externas. Por ejemplo, la cutícula o la piel constituyen una barrera contra los patógenos que entran en contacto con el cuerpo del animal. La fagocitosis de bacterias invasoras es otro ejemplo de mecanismo de defensa inespecífico. Las inmunorreacciones innatas suelen ser activadas por las propiedades químicas del agente extraño.
Los mecanismos de defensa específicos están destinados de manera exclusiva a combatir macromoléculas específicas propias de cada agente patógeno. Las inmunorreacciones específicas también se denominan inmunorreacciones adquiridas o adaptativas. Las inmunorreacciones (o inmunorrespuestas) específicas están dirigidas hacia el tipo específico de sustancia extraña o agente patógeno que ha penetrado en el cuerpo del animal. Cualquier molécula que pueda se: reconocida de manera específica como extraña por células del sistema inmunitario se denomina antígeno. Muchas macromoléculas, incluídas proteínas, ARN, ADN y algunos carbohidratos, son antígenos. Un mecanismo de defensa específico importante es la producción de anticuerpos, proteínas altamente específicas que reconocen antígeno; específicos y se unen a ellos. En los animales complejos, en los mecanismos de defensa específicos participa la memoria inmunitaria, que es la capacidad de reaccionar de manera más eficaz la segunda ocasión que moléculas extrañas dadas invaden el cuerpo.
A veces el sistema inmunitario funciona incorrectamente y ataca los tejidos corporales como si éstos fueran patógenos. Otras veces el cuerpo es superado por los patógenos. El virus de la inmunodeficiencia humana (VIH), que causa el SIDA, infecta linfocitos T, componentes importantes del sistema inmunitario.
El concepto de inmunidad puede venir de tiempos muy remotos, como lo sugiere la costumbre china de hacer a los niños resistentes al smallpox mediante la inhalación de polvo obtenido de las lesiones de la piel de los enfermos durante su etapa de recuperación.
Se puede manipular la función del sistema inmune bajo condiciones controladas, tal como ocurre en la vacunación. Como se menciona más arriba, el primer ejemplo de este tipo de manipulación fue la vacunación exitosa realizada por Edward Jenner, un médico inglés, contra la viruela. A Jenner le llamó la atención que los lactantes que se recuperaban de la enfermedad nunca la desarrollaban de nuevo. En base a esto, inyectó material extraído de una pústula en el brazo de una niño de 8 años. Cuando este niño fue después inoculado intencionalmente con el agente de la viruela no se desarrolló la enfermedad. Este método introducido el año 1798 permanece hasta ahora como la forma más efectiva de prevenir las infecciones.
Para dimensionar el efecto que ha tenido la comprensión del sistema inmune y su manipulación mediante la vacunación masiva, puede revisarse la siguiente tabla, que muestra la efectividad de la vacunación para algunas enfermedades infecciosas corrientes.
| Figura 15. ( arriba ) Estadísticas anuales para algunas de las enfermedades infecciosas más comunes en Chile. Para todos los casos, la columna con cifras de 1992 implican el desarrollo y aplicación de vacunas específicas para cada enfermedad |
Existen componentes de la inmunidad que son innatos e inespecíficos
La inmunidad innata o inespecífica incluye aquellos mecanismos que posee el organismo para combatir a los microbios antes de que ocurra una infección. Corresponde a la primera línea de defensa contra los agentes patógenos. Entre sus principales componentes se encuentran las barreras físicas y químicas, células fagocíticas y proteínas plasmáticas.
La piel constituye una gruesa barrera física que impide o dificulta el ingreso de los patógenos. Además, su permanente renovación permite la eliminación de aquellos microorganismos que se encuentren en su superficie. Es muy poco probable que las bacterias ingresen por la piel si esta está intacta. En cambio, cuando se rompe por algún corte o quemadura, sirve de canal expedito para las infecciones. Junto con ser una barrera física, impuesta principalmente por la queratina, la piel posee mecanismos químicos de defensa: el sudor y el sebo. Mientras el sudor aporta lisozima, enzima que degrada las paredes celulares de las bacterias, el sebo acidifica la superficie de la piel, lo que también inhibe el crecimiento bacteriano. La lisozima también está presente en las lágrimas y la saliva.
Los microorganismos que ingresan en el cuerpo con el alimento suelen ser destruidos por las secreciones ácidas y enzimas del estómago. . Los patógenos que entran en el cuerpo con el aire inhalado suelen ser filtrados por los pelos de la nariz o atrapados por el revestimiento mucoso adhesivo de las vías respiratorias, donde por lo común destruidos por fagotitos ( fig.16 )
| Figura 16. Macrófagos atrapando y fagocitando bacterias |
Los fagocitos son, precisamente, la segunda línea defensiva. Corresponden a glóbulos blancos, ya sea macrófagos o neutrófilos. Los macrófagos derivan de un precursor presente en la sangre, que aún no ha terminado su diferenciación, el monocito. Cuando el monocito abandona la sangre y pasa a ciertos tejidos, completa su diferenciación y origina a los macrófagos. Cada macrófago puede llegar a fagocitar cerca de 100 bacterias en su vida. Un neutrófilo, en cambio, alcanza solo 20 bacterias. En ambos casos, la fagocitosis es inespecífica, vale decir, se produce frente a cualquier partícula extraña, sea un microorganismo o no. Todos los animales poseen – al menos – un mecanismo defensivo de este tipo, que se considera la forma más antigua de inmunidad.
Las células del sistema inmunitario secretan una notable cantidad de proteínas reguladoras llama citocinas, que cumplen la importante función de constituir señales para las células durante las inmunorreacciones. Al igual que las hormonas, las citocinas actúan en las células que las producen, regulan la actividad de células vecinas, y en algunos casos modifican las acciones de éstas. Algunos tipos de citocinas son: interferones, interleucinas y factores de necrosis tumoral.
Cuando un virus u otros parásitos intracelulares infectan células, éstas reaccionan secretando citocinas llamadas interferones. Los interferones tipo I son producidos por macrófagos o por fibroblastos de tejidos conectivos. Los interferones tipo I inhiben la multiplicación viral y también activan las llamadas células citolíticas naturales con acciones antivirales. Las partículas vírales producidas en células expuestas a interferones tipo I no son muy eficaces para infectar más células. Otro grupo, los interferones tipo II, producidos por una parte del sistema de inmunidad específica, incrementan las actividades de otras células inmunitarias. Los miembros de este grupo pueden estimular macrófagos para que destruyan células tumorales y células que han sido infectadas por virus.
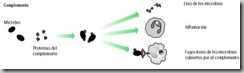
Finalmente, existen las proteínas del complemento.
El complemento, así llamado porque complementa la acción de otros mecanismos de defensa, consiste en más de 20 proteínas presentes en el plasma y otros líquidos corporales. En condiciones normales, las proteínas del complemento son inactivas hasta que el cuerpo se expone a un antígeno. Determinados patógenos activan de manera directa el sistema del complemento. En otros casos, cuando antígeno y anticuerpo se combinan estimulan la activación. La activación del complemento consiste en una cascada de reacciones donde cada componente actúa sobre el siguiente de la serie. Las proteínas de este sistema actúan entonces para destruir los patógenos.
Las proteínas del complemento pueden ser activadas contra cualquier antígeno, y su acción es inespecífica. Una vez activadas emprenden cuatro acciones principales: (1) algunas lisan la pared celular del patógeno; (2) otras recubren a los patógenos, haciéndolos menos "resbalosos" para que los fagocitos (macrófagos y neutrófilos) puedan fagocitarlos con mayor facilidad, un proceso llamado opsonización; (3) otras más atraen linfocitos al sitio de la infección; (4) aun hay las que incrementan la inflamación estimulando la liberación de histamina y otros compuestos que dilatan los vasos sanguíneos e incrementan la permeabilidad de los capilares.
Figura 17. Componentes de la inmunidad innata
Los mecanismos de defensa específicos o adaptativos incluyen inmunidad mediada por anticuerpos y por células
| Figura 18. Principales órganos linfáticos |
Mientras los mecanismos de defensa inespecíficos destruyen patógenos e impiden que la infección se disperse, el organismo moviliza una gran gama de mecanismos de defensa específicos. Este tipo de inmunidad es el más evolucionado de todos los mecanismos de defensa. Es estimulada por la exposición a agentes infecciosos y va aumentando en magnitud y capacidad defensiva con cada exposición sucesiva a un microbio particular.
Se requieren varios días para activar inmunorreacciones específicas, pero, una vez montadas, son extremadamente eficaces. Dos tipos principales de inmunidad específica son la mediada por anticuerpos y la mediada por células.
En el caso de la inmunidad específica mediada por células participan fagocitos y linfocitos. Se trata de los mismos fagocitos de la inmunidad inespecífica, pero cumpliendo un rol de colaboración con los linfocitos.
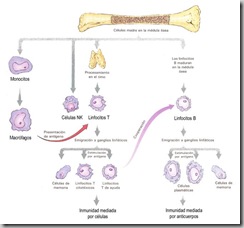
Los linfocitos son células que se desarrollan y maduran en órganos linfáticos primarios, incluyendo médula ósea y timo. Los órganos linfáticos secundarios, donde residen grandes cantidades de linfocitos, son bazo, ganglios linfáticos y otros tejidos linfáticos estratégicamente ubicados en todo el cuerpo. Ver figura 18.
Los linfocitos se clasifican en tres grupos: linfocitos citolíticos, linfocitos T, que pueden ser de ayuda (auxiliares o Th por “helpers”) o citotóxicos (asesinos o Tk por “killers”) y linfocitos B, que son los que originan anticuerpos. El esquema de la figura 19 resume la formación de todas las células involucradas en la inmunidad específica, ya sea por anticuerpos o por células propiamente tal.
En la inmunidad mediada por anticuerpos o inmunidad humoral, los linfocitos B maduran para convertirse en células plasmáticas que producen anticuerpos específicos. La activación de los linfocitos B es un proceso complejo que requiere la participación de los llamados linfocitos T de ayuda. En la inmunidad mediada por células o inmunidad celular, linfocitos citolíticos atacan células corporales infectadas por patógenos invasores o alteradas por mutación (células cancerosas).
Si bien los linfocitos T y B tienen diferentes funciones y ciclos vitales, son similares en aspecto cuando se examinan al microscopio, mediante técnicas más complejas como la microscopia de fluorescencia se ha demostrado que los T y B pueden diferenciarse por sus proteínas de superficie celular específicas. También tienden a localizarse en regiones distintas de bazo, ganglios y otros tejidos linfáticos.
Células de la inmunidad específica: Macrófagos
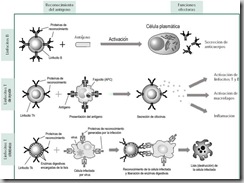
Más arriba se dijo que además de su rol preponderante en la inmunidad innata, los fagocitos tienen un rol activo en la inmunidad específica, colaborando con los linfocitos. Cuando un macrófago engulle una bacteria, la mayor parte de los antígenos bacterianos son degradados por enzimas lisosómicas. Algunos fragmentos de esos antígenos se unen a ciertas proteínas receptoras llamadas de histocompatibilidad (MHC) y son exhibidos en la superficie del macrófago. Por este motivo, al macrófago se le considera una célula “presentadora de antígeno” que exhibe antígenos bacterianos así como sus propias proteínas de superficie. El complejo “antígeno-molécula de histocompatibilidad” activa a linfocitos Th, los que, a su vez, activan a los linfocitos B. Ver figura 20.
| Figura 19. Formación de las células involucradas en la inmunidad específica |
Cabe señalar que un antígeno no solo puede ser una molécula específica de la superficie bacteriana. También puede tratarse de una toxina, un virus o incluso sustancias inorgánicas como una partícula de polvo o de metal. En síntesis cualquier sustancia extraña para el organismo.
Los macrófagos secretan unos 100 compuestos diferentes, incluyendo interferones y enzimas que destruyen bacterias. Cuando son estimulados por bacterias, macrófagos secretan interleucinas, que activan linfocitos B y linfocitos T . Las interleucinas también promueven una respuesta general a la lesión, causando fiebre y activando otros mecanismos que defienden el cuerpo contra la invasión.
Células de la inmunidad específica: Linfocitos citolíticos
Los linfocitos citolíticos (también llamados células NK) se originan en la médula ósea y destruyen las células blanco mediante la liberación de citocinas (como los interferones), así como enzimas digestivas llamadas perforinas y granzimas. Junto con este mecanismo inespecífico, pueden desarrollar mecanismos específicos mediados por anticuerpos.
La actividad de los linfocitos citolíticos es estimulada por varias citocinas, incluyendo interferón gamma. Cuando las concentraciones de estas células son altas, la resistencia a determinadas formas de cáncer aumenta. Se piensa que algunos estresantes reducen la actividad de linfocitos citolíticos y, por tanto, favorecen el crecimiento tumoral.
Células de la inmunidad específica: Linfocitos T
| Figura 20. Estimulación de un linfocito B mediante presentación de antígeno desde un fagocito, mediado por un linfocito Th.. El mecanismo se puede resumir de la siguiente manera: El patógeno (que porta antígenos) invade el cuerpo à la APC fagocita el patógeno à se exhibe el complejo “antígeno extraño-MHC” en la superficie de Ia APC à el linfocito Th se une al complejo “antígeno extraño-MHC” à el linfocito Th activado interactúa con un linfocito B que exhibe el mismo complejo à el linfocito B es activado à se produce una clona de linfocitos B à linfocitos B se diferencian à células plasmáticas secretan anticuerpos à los anticuerpos forman complejos con el patógeno à los complejos de anticuerpo activan procesos que llevan a la destrucción del patógeno |
Los linfocitos T se originan de células madre en la médula ósea. En su camino hacia los tejidos linfáticos, los futuros linfocitos T se detienen en el timo para su procesamiento. (La letra T indica que estas células derivan del timo). Esta glándula hace a los linfocitos inmunocompetentes, o sea, capaces de montar una respuesta inmune. A medida que dichas células avanzan en el timo, se dividen muchas veces y desarrollan proteínas de superficie específicas con sitios receptores característicos. Sólo los linfocitos T que poseen receptores específicos son seleccionados para dividirse.
Si bien los linfocitos Tk actúan en forma inespecífica, destruyendo en forma directa las células infectadas por virus, las bacterias y las células cancerosas o provenientes de injertos, los linfocitos Th son parte de la respuesta específica que promueve la liberación de anticuerpos por parte de los linfocitos B. Ver figura 20.
Células de la inmunidad específica: Linfocitos B
Diariamente se producen en la médula ósea millones de linfocitos B. Estos maduran en el hígado fetal y en la médula ósea adulta (el nombre de linfocito B proviene de este hecho, ya que “bone marrow” significa médula ósea). Cada linfocito B está programado genéticamente para codificar un receptor de glucoproteína que se une a un tipo específico de antígeno. Cuando un linfocito B entra en contacto con el antígeno que se une a sus receptores, se divide con rapidez para formar muchas células idénticas, lo que se denomina una “clona” de linfocitos B. Estos linfocitos B se diferencian en células plasmáticas, que producen y secretan anticuerpos, una forma soluble de la molécula receptora. Una célula plasmática puede producir la sorprendente cantidad de más de 10 millones de moléculas de anticuerpo por hora. El anticuerpo se une al antígeno que originalmente activó los linfocitos B.
Algunos linfocitos B activados no se transforman en células plasmáticas, sino en linfocitos B de memoria, que continúan produciendo pequeñas cantidades de anticuerpo después de que se ha superado una infección.
De esta forma, los linfocitos T y B son activados de distinta manera y aunque tienen distintas funciones, consiguen el mismo efecto final: deshacerse de células dañadas y microorganismos patógenos. Ver figura 21.
Los anticuerpos son complejos proteicos específicos que poseen variados mecanismos de acción
Una molécula de anticuerpo cumple dos funciones principales: se combina con antígeno y activa procesos que lo destruyen, por ejemplo, la fagocitosis. El anticuerpo no destruye al antígeno directamente; más bien, lo etiqueta para su destrucción. La parte de un anticuerpo que se une a un antígeno es la porción Fab. La que interactúa con células del sistema inmunitario es su porción Fc. Muchas de estas células tienen receptores para Fc.
| Figura 21. Resumen del mecanismo de acción de tres tipos de linfocitos: · Los linfocitos B reconocen antígenos solubles y se transforman en células secretoras de anticuerpos (células plasmáticas) · Los linfocitos T de ayuda (Th) reconocen antígenos sólo cuando les son presentados en la superficie de otras células que han fagocitado previamente bacterias. Al reconocer al antígeno se activan y producen citocinas que estimulan diversos mecanismos de inmunidad e inflamación: activan a las células B y a los macrófagos para que eliminen los microbios que han fagocitado. · Los linfocitos T citotóxicos (Tk) reconocen antígenos que son presentados por células infectadas por virus y lisan a estas células infectadas. · Los linfocitos exterminadores naturales (no esquematizados) participan en la inmunidad innata eliminando células infectadas. En todos estos casos es crucial el reconocimiento del antígeno por el receptor de la célula T. Los anticuerpos también son específicos en su reconociemiento de los antígenos solubles. |
¿Cómo es que los anticuerpos, también llamados inmunoglobulinas o Ig, "reconocen" antígenos? En un antígeno consistente en una proteína, secuencias específicas de aminoácidos constituyen un determinante antigénico (figura 22). Estos aminoácidos dan a parte de la molécula de antígeno una forma específica que puede ser reconocida por un anticuerpo o receptor de linfocito T. Por lo común, un antígeno tiene muchos determinantes antigénicos distintos en su superficie, y algunos tienen cientos. Tales determinantes antigénicos suelen diferir entre sí, de modo que varios tipos distintos de anticuerpos pueden combinarse con un solo antígeno.
Un anticuerpo típico es una molécula en forma de Y, donde los dos brazos de laY (la porción Fab) se unen con el antígeno. Esta forma permite al anticuerpo combinarse con dos moléculas de antígeno y hace posible la formación de complejos antígeno-anticuerpo. Mientras los brazos se unen a antígeno, la cola de la Y (la porción Fc) interactúa con células del sistema inmunitario, como fagocitos, o se une a moléculas del sistema del complemento.
La porción del anticuerpo que es específica para cada antígeno es la parte terminal de la porción Fab. El resto de la estructura del anticuerpo, especialmente la porción Fc es mas bien constante.
Tal como una unión enzimática, el contacto entre el extremo de la porción Fab y el determinante antigénico es muy específica. Cuando se unen, tal como ocurre con una llave y su cerradura, los bordes complementarios se estrechan aún más, generando un vínculo muy estrecho.
Los anticuerpos etiquetan un patógeno como ajeno combinándose con un antígeno de su superficie. Por lo general, varios anticuerpos se combinan con varios de tales antígenos y crean una masa de complejos antígeno-anticuerpo agregados. La combinación de antígeno y anticuerpo activa varios mecanismos de defensa:
· El complejo antígeno-anticuerpo puede desactivar el patógeno o su toxina. Por ejemplo, cuando un anticuerpo se une a la superficie de un virus, éste pierde su capacidad de unirse a una célula huésped.
· El complejo antígeno-anticuerpo estimula las células fagocíticas a ingerir el patógeno.
· Cierto grupo de anticuerpos (IgG e IgM) trabajan principalmente a través del sistema del complemento. Cuando los anticuerpos se combinan con un antígeno específico en la superficie de un patógeno, proteínas del complemento destruyen los patógenos. Los anticuerpos IgG tienen una parte Fc de la molécula que se une a receptores de Fc, que se expresan en casi todas las células inmunitarias. Cuando la parte Fc de una molécula de anticuerpo que se ha unido a un patógeno se enlaza a receptores de Fc en un fagocito, el patógeno puede ser destruido con mas facilidad. Ver figura 22.
Estructura de un anticuerpo (abajo) y variedad de mecanismos de acción ( fig. 22 )
La respuesta inmune es el proceso que integra a todos los mecanismos de inmunidad
Hasta aquí hemos explicado los mecanismos específicos que desarrollan las células del sistema inmune para defendernos de los microbios. Sin embargo, la respuesta inmune es un fenómeno mucho más amplio y que involucra especialmente a los órganos linfáticos secundarios. Recordemos que los órganos linfáticos primarios (médula ósea y timo), se denominan así por ser generadores de linfocitos T y B
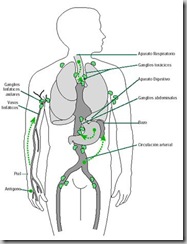
A pesar que el sistema inmunológico está organizado en base a órganos bastante difusos, en el sentido de ubicarse en varios lugares del cuerpo, los vasos linfáticos sirven de conductos unificadores, que complementan su función homeostática (en la absorción y la regulación hídrica) con la inmunológica. Básicamente, las vasos linfáticos sirven de ruta para devolver a la sangre los líquidos intersticiales. Estratégicamente colocados dentro de este sistema de vasos, se encuentran los ganglios linfáticos , que son masas de tejido esponjoso separadas en varios compartimentos. Los ganglios linfáticos sirven de filtros, pues extraen de la circulación microbios, partículas extrañas, restos tisulares y células muertas. Están determinadas áreas, como el cuello, axila e ingle. El bazo y las amigdalas son también ricos en linfocitos y macrófagos. Otros nódulos de tejido linfoide, situados dentro de la pared intestinal, defienden el cuero contra los billones de microorganismos que viven normalmente en el tubo digestivo. De esta manera, y tal como lo muestra la figura 23, cualquier antígeno que penetre al organismo a través de una herida en las extremidades o en la cavidad bucal, circulará por vasos linfáticos que convergerán necesariamente en ganglios ubicados “al ingreso del tronco”.
En la figura 24 se resumen los eventos de la respuesta inmune que ocurren tras el contacto con el antígeno. Tal como se señala, el efecto último es la activación de los linfocitos B y T, para que actúen como células efectoras en los tejidos afectados: células plasmáticas y linfocitos Th y Tk activos. No obstante, también se produce una gran cantidad de linfocitos de memoria, los que serán responsables de respuesta inmunes más efectivas, cuando se vuelva a tener contacto con ese antígeno. Esto es especialmente válido para la inmunidad frente a enfermedades. Por ejemplo, el hecho que la varicela o peste cristal sólo se produzca una vez en el vida, se debe a la presencia de linfocitos B y T de memoria en la circulación, que conservaron información específica del virus de la enfermedad en su primer contacto, lo que imposibilita nuevas infecciones a pesar de los “intentos” del virus.
Fig . 23 Sitios de entrada y transporte de los antígenos a los órganos linfáticos
Esta condición explica porque existen respuestas inmunes primarias y secundarias. La primera exposición a un antígeno estimula una reacción primaria. La inyección
| Figura 24. Eventos de la inmunidad adquirida que ocurren en los ganglios linfáticos |
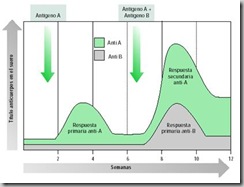
de un antígeno en un animal hace que aparezcan anticuerpos específicos en el plasma sanguíneo en 3 a 14 días. Después de la inyección del antígeno hay un breve periodo latente, durante el cual el antígeno es reconocido y los linfocitos apropiados comienzan a formar clonas. Durante la fase logarítmica que sigue, la concentración de anticuerpo asciende con rapidez durante varios días hasta alcanzar un máximo (figura 25). Por último, hay una fase de declinación, durante la que la concentración de anticuerpo disminuye a un nivel muy bajo.
Fig 25-. Diferencias entre la respuesta inmune primaria y secundaria
Una segunda inyección del mismo antígeno, incluso años después, evoca una reacción secundaria. Puesto que incluso por años suelen persistir células de memoria con anticuerpos contra ese antígeno, la respuesta secundaria es en general mucho más rápida que la primaria, con un periodo latente más corto. Se requiere mucho menos antígeno para estimular una respuesta secundaria que una primaria y se producen más anticuerpos. La afinidad de los anticuerpos suele ser mucho mayor.
La capacidad del organismo de montar una respuesta rápida y eficaz durante el segundo encuentro con un antígeno explica porqué no solemos sufrir varias veces la misma enfermedad infecciosa. Valga nuevamente el ejemplo de la varicela.
¿Cómo es entonces que una persona puede sufrir gripe o resfrío (ambas producidas por virus) más de una vez. Por desgracia, hay muchas variedades de estas enfermedades, cada una causada por un virus con antígenos ligeramente distintos. Por ejemplo, más de 100 virus distintos causan el resfriado común, y continuamente surgen nuevas variantes de virus de resfrío y gripe por mutación (que para ellos es un mecanismo de supervivencia), lo que da por resultado cambios en sus antígenos de superficie. Incluso un pequeño cambio puede impedir el reconocimiento por células de memoria. Puesto que el sistema inmunitario es muy específico, cada antígeno diferente es tratado por el cuerpo como un nuevo desafío inmunitario.
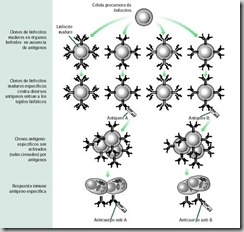
Ahora bien, ¿de qué manera se elaboran linfocitos que respondan específicamente a la gran gama de antígenos que ingresan permanentemente al organismo? Hay varias pistas que lo explican. Los linfocitos B y T están compuestos por poblaciones de linfocitos cuyos miembros se distinguen entre ellos porque cada uno expresa en su superficie un receptor distinto y específico para un antígeno
| Figura 26. Selección clonal |
.
particular. Esto define el repertorio de alrededor de 109-1011 antígenos distintos que pueden ser reconocidos (lo que equivale a unas 150 veces la población de todo el planeta). El organismo humano generalmente contiene más de 100 mil millones de linfocitos B, cada uno de los cuales secreta un anticuerpo diferente de los otros.
Tal como se explica en la figura 26 , durante la respuesta inmune se activan y proliferan sólo aquellos linfocitos que poseen el receptor para el antígeno agresor. Es lo que denomina la selección clonal. Según esta hipótesis, cada antígeno “selecciona” (en realidad, se une arbitrariamente) a un clon, entre varias células provenientes del mismo linfocito precursor. La unión del linfocito con el antígeno, como ya hemos visto, estimula su proliferación y diferenciación en células plasmáticas. Un principio similar se aplica a los linfocitos T. Sólo se seleccionan los que reconocen al antígeno particular extraño al organismo.
Es posible inducir inmunidad activa mediante inmunización
Se ha venido considerando la inmunidad activa, que se desarrolla después de la exposición a antígenos. Si tuviste varicela, por ejemplo, desarrollaste inmunidad que te protege de volver a contraerla. La inmunidad activa puede ser inducida de manera natural o artificial. Si alguien con varicela estornuda cerca tuyo y te contagia la enfermedad, desarrollas inmunidad activa naturalmente. La inmunidad activa también puede inducirse artificialmente por inmunización; esto es, por exposición a una vacuna.
La vacunación eficaz depende de la posibilidad de estimular al organismo a montar una inmunorreacción contra los antígenos contenidos en la vacuna. Se producen células de memoria, y en encuentros posteriores con el mismo patógeno las defensas actúan con rapidez.
Existen varias maneras de elaborar vacunas eficaces. Un virus puede ser atenuado mediante pasos sucesivos por células de huéspedes no humanos. En el proceso ocurren mutaciones que adaptan el patógeno al huésped no humano, de modo que ya no puede causar enfermedad en personas. Es así como se producen la vacuna Sabin contra la poliomielitis y la vacuna contra el sarampión. Las vacunas contra tos ferina y tifoidea se hacen con patógenos muertos que aún tienen los antígenos necesarios para estimular una inmunorreacción. Las vacunas contra tétanos y botulismo se elaboran con toxinas secretadas por los patógenos respectivos. La toxina es modificada de modo que ya no pueda destruir tejidos, pero sus determinantes antigénicos siguen intactos.
La mayor parte de las vacunas constan del patógeno completo, atenuado o muerto, o de una de sus proteínas. En la actualidad, los investigadores analizan varios métodos para reducir los efectos colaterales potenciales. Por ejemplo, están creando vacunas que consisten en péptidos sintéticos que son sólo una pequeña parte del antígeno. Otro método nuevo es el desarrollo de vacunas de ADN, elaboradas con parte del material genético del patógeno que codifica antígenos. Cuando alguna de estas vacunas es introducida en el cuerpo, el sistema inmunitario desarrolla activamente clonas, produce anticuerpos y genera células de memoria.
En la inmunidad pasiva, se administran a un individuo anticuerpos producidos activamente por otro organismo. Pueden obtenerse de personas o animales suero o gamma globulina que contienen estos anticuerpos. Los sueros de animales son menos deseables porque sus proteínas no humanas pueden por sí mismas actuar como antígenos y estimular una inmunorrespuesta que dé por resultado un trastorno llamado enfermedad del suero. En la figura 27 se esquematizan ambos tipos de inmunidad.
| Figura 27. Inmunidad activa y pasiva |
La inmunidad pasiva en el fondo es "prestada", y sus efectos no son duraderos. Se administra para reforzar temporalmente las defensas del cuerpo contra una enfermedad específica. Por ejemplo, cuando a alguien se le diagnostica hepatitis A (una forma de hepatitis viral que se propaga por alimento o agua contaminados), puede inyectarse a personas con riesgo de infección gamma globulina que contenga anticuerpos contra el virus de la hepatitis. Sin embargo, tales inyecciones confieren protección por sólo unas cuantas semanas. Puesto que el organismo no montó activamente una inmunorreacción, no tiene células de memoria y no puede producir anticuerpos contra el patógeno. Una vez que los anticuerpos inyectados se degradan, la inmunidad desaparece.
Las mujeres embarazadas confieren inmunidad pasiva natural a sus bebés en desarrollo al producir anticuerpos para ellos. Estos anticuerpos maternos, de la clase IgG, atraviesan la placenta (el órgano de intercambio entre madre y feto) y dan a feto y lactante un sistema de defensa hasta que madura su propio sistema inmunitario. Los bebés alimentados al pecho continúan recibiendo inmunoglobulinas de la leche, particularmente IgA.























No hay comentarios:
Publicar un comentario