LA BASE FISICO QUÍMICO DE LA VIDA
BIOELEMENTOS O ELEMENTOS BIOGÉNICOS
Son los elementos que forman parte de los seres vivos. Los podemos clasificar en:BIOELEMENTOS PRIMARIOS: C, H, N, O, P, S. Representan alrededor del 96% del total, por lo que constituyen la práctica totalidad de las moléculas biológicas.
Estos son los elementos idóneos para formar los edificios moleculares de los seres vivos por tener en común las siguientes características:
Encontrarse en las capas más externas de la Tierra (corteza, atmósfera e hidrosfera).
La mayoría de los compuestos químicos formados por estos elementos presentan polaridad por lo que fácilmente se disuelven en el agua, lo que facilita su incorporación o su eliminación.
El C y el N presentan la misma afinidad para unirse tanto al Oxígeno como al hidrógeno, es decir pasan con la misma facilidad del estado oxidado (CO2, HNO3) al reducido (CH4, NH3). Esto es de gran importancia en los procesos de oxidación reducción que son la base de muchas reacciones químicas.
El C, H, O y N (por tener de 4 a 6 electrones en su última capa) presentan variabilidad de valencias y por ello forman con facilidad enlaces covalentes. A su vez son los elementos más pequeños (tienen pesos atómicos bajos) capaces de formar enlaces covalentes estables (la estabilidad de un enlace covalente está en relación inversa con el tamaño del átomo).
 Esto es lo que permite a los átomos de carbono establecer con facilidad enlaces covalentes sencillos, dobles o triples entre ellos o con los de hidrogeno, oxigeno, nitrógeno, azufre, etc., dando lugar a cantidad de grupos funcionales que pueden reaccionar entre sí y originar nuevas moléculas orgánicas con diversos grupos funcionales. Todo ello resulta útil para las continuas transformaciones que sufre la materia de los seres vivos en su metabolismo.
Esto es lo que permite a los átomos de carbono establecer con facilidad enlaces covalentes sencillos, dobles o triples entre ellos o con los de hidrogeno, oxigeno, nitrógeno, azufre, etc., dando lugar a cantidad de grupos funcionales que pueden reaccionar entre sí y originar nuevas moléculas orgánicas con diversos grupos funcionales. Todo ello resulta útil para las continuas transformaciones que sufre la materia de los seres vivos en su metabolismo. Por otro lado, los enlaces carbono -carbono son estables y forman largas y variadas cadenas carbonadas:
. Cadenas lineales con todo tipo de enlaces:
 . Cadenas ramificadas:
. Cadenas ramificadas:  Cadenas cíclicas, cuando los extremos de la cadena aparecen unidos entre sí dando origen a estructuras cíclicas o anillos.
Cadenas cíclicas, cuando los extremos de la cadena aparecen unidos entre sí dando origen a estructuras cíclicas o anillos.  Además, la estructura tetraédrica de los compuestos de carbono proporciona a las moléculas una configuración
Además, la estructura tetraédrica de los compuestos de carbono proporciona a las moléculas una configuración tridimensional de la que derivan sus múltiples funciones.
BIOELEMENTOS SECUNDARIOS: Na +, K+, Ca2+, Mg2+, Cl En medio acuoso se encuentran siempre ionizados. Aunque se encuentran en menor proporción que los primarios, son imprescindibles para los seres vivos.
OLIGOELEMENTOS O ELEMENTOS VESTIGIALES: se encuentran en cantidades inferiores al 0´1%. Son imprescindibles para la vida aunque no todos los seres vivos tienen los mismos.
Como oligoelementos más universales podemos citar, Fe, Cu, Zn, Mn, I, Ni, Co.
GRUPOS FUNCIONALES
BIOMOLÉCULAS
Lo normal es que los bioelementos no se encuentren libres sino que se unen entre sí mediante enlaces dando lugar a las biomoléculas:
Los enlaces son las fuerzas de atracción que mantienen unidos a los átomos. En el caso de las biomoléculas pueden ser fuertes (covalente) y débiles. (no covalentes)
Enlaces
1. Iónico
2. Covalente
3. Enlaces débiles/intermoleculares
· Enlaces de hidrógeno: Se da en moléculas en las que el H está unido a átomos muy electronegativos (O,N); ésto confiere polaridad a la molécula. Las cargas + y – que se crean, se atraen estableciéndose este tipo de enlaces.
· Fuerzas de Van der Waals: Se producen por atracción electrostática entre los núcleos de una molécula y los electrones de otra. Estas fuerzas son mayores cuantos más electrones tienen las moléculas.
· Enlaces hidrofóbicos: Se da entre átomos que no tienen afinidad por el agua
Los átomos de las moléculas biológicas suelen estar unidos por enlaces covalentes (formados al compartir entre ellos pares de electrones) constituyendo las moléculas sillares o monómeros (glucosa, aminoácidos etc.). Estos monómeros, a su vez, se unen mediante enlaces también covalentes formando los polímeros.
Los polímeros son moléculas complejas formadas por la unión de muchos monómeros (almidón, proteínas, etc.).
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS
PRINCIPIOS INMEDIATOS INORGÁNICOS
EL AGUA
La substancia más abundante en las células no es especial ya que cubre las 3/4 partes de la superficie terrestre.El agua constituye el 70% aproximadamente en peso de las células.
La cantidad de agua depende de las especies: las acuáticas poseen un mayor porcentaje que las terrestres, por ejemplo, en las medusas un 95%. En el hombre depende de la edad, en los individuos jóvenes existe mayor cantidad que en los adultos (carne de ternera más blanda que la de vaca), y también del órgano y del tejido, a mayor actividad metabólica mayor proporción de agua (la corteza cerebral 90% y el tejido adiposo 10-20%).
En los seres vivos pluricelulares localizamos el agua bajo dos formas:
agua intracelular: 2/3 del total de agua presente (aproximadamente)
agua extracelular: 1/3 del total. Esta constituida por el agua intersticial (en los tejidos bañando a las células) y el agua circulante (sangre, linfa, savia, etc.).
En los seres unicelulares será su medio ambiente.
La vida en este planeta empezó en el mar y las condiciones que reinaban en aquel ambiente primitivo imprimieron un sello permanente en la química de la materia viva. Todos los organismos han sido diseñados alrededor de las propiedades características del agua, tales como su carácter polar, sus enlaces hidrogeno, su elevado punto de fusión, ebullición, calor específico y su elevada tensión superficial.
ESTRUCTURA QUÍMICA DE LA MOLÉCULA.
Las propiedades físicoquímicas del agua son consecuencia de su estructura química y de ellas derivan sus funciones biológicas. En la molécula del agua, el átomo de oxígeno comparte un par de electrones con cada uno de los átomos de hidrógeno siendo una molécula angulada.POLARIDAD
Así, el núcleo del átomo de oxígeno, debido a su mayor electronegatividad, desplaza parcialmente a los electrones que constituyen los enlaces hacia su núcleo dejando a los núcleos de los átomos de hidrógeno con una pequeña carga parcial positiva (d+); mientras que existen regiones débilmente negativas (d-) cerca del átomo de oxígeno.Por ello, la molécula de agua tiene en su estructura unas zonas con mayor densidad electrónica y otras con un déficit electrónico; lo que hace que sea una molécula dipolar.
SUBSTANCIA
ENLACES DE HIDRÓGENO:
Como consecuencia de la estructura dipolar, las moléculas de agua pueden interaccionar unas con otras. Esta interacción se produce por atracción electrostática entre la carga parcial negativa del átomo de oxígeno de una molécula de agua y la carga parcial positiva localizada sobre los átomos de hidrógeno de otra molécula. Estas uniones se denominan enlaces de hidrógeno.

Debido a la ordenación de los electrones alrededor de los átomos de oxígeno, cada molécula de agua es potencialmente capaz de unirse mediante enlaces de hidrógeno a otras moléculas de agua, lo que permite que se formen estructuras de tipo reticular Estos enlaces de hidrogeno entre las moléculas se forman y escinden a una gran velocidad, aunque su estabilidad disminuye al elevarse la temperatura.
Los enlaces de hidrógeno mantienen unidas a las moléculas de agua entre sí, con lo que su peso molecular aumenta, y por ello, a una temperatura a la que otras moléculas químicamente comparables (H2S o CH4) están en estado gaseoso, el agua se encuentra en estado líquido.
Como consecuencia, el agua se emplea como medio fluido de transporte entre las diferentes partes de un organismo, y como medio lubricante en órganos de movimiento.
PROPIEDADES DEL AGUA
COHESIVIDAD
La cohesividad es la fuerza que mantiene unidas a las moléculas de agua y esta fuerza viene determinada por los puentes de hidrógenoLas fuerzas cohesivas debidas a la elevada tendencia de la molécula de agua a unirse a otras moléculas vecinas, son las que convierten al agua en un líquido prácticamente incompresible, capaz de dar volumen y turgencia a muchos seres vivos, por ejemplo el esqueleto hidrostático de las plantas.
Además esta naturaleza cohesiva del agua es responsable de muchas de sus propiedades, tales como su elevada tensión superficial, su elevado calor específico y su elevado punto de ebullición.
Elevada tensión superficial; esta propiedad permite deformaciones en el citoplasma celular, causa de los movimientos internos de la célula.
Elevado calor específico; así al comunicar una cierta cantidad de calor, la temperatura se eleva poco y, de la misma forma, al liberar energía por enfriamiento, la temperatura desciende mas lentamente que en otros líquidos.
Esto permite que el agua actúe como un amortiguador térmico, manteniendo la temperatura del organismo relativamente constante, a pesar, de las fluctuaciones ambientales.
De esta forma se evita la alteración de algunas moléculas, fundamentalmente proteínas, muy sensibles a los cambios térmicos.
Elevado calor de vaporización; la evaporación de agua precisa una considerable cantidad de energía pues es necesario romper los enlaces de hidrógeno existentes en la fase líquida.
Esta propiedad, junto con la anterior, participa en el proceso de amortiguación térmica, pues se consigue una disminución de la temperatura de un organismo al perder una cantidad de calor que es empleada en la evaporación del agua. La sudoración es un método fisiológico de refrigeración, basado en esta propiedad.
SOLUBILIDAD
El agua por su naturaleza dipolar es un buen disolvente para gran cantidad de compuestos: Compuestos iónicos, como las sales cristalizadas; por ser el agua dipolar se interpone entre los compuestos iónicos disminuyendo la fuerza de atracción de los iones y provocando su separación y por tanto su disolución.
Compuestos iónicos, como las sales cristalizadas; por ser el agua dipolar se interpone entre los compuestos iónicos disminuyendo la fuerza de atracción de los iones y provocando su separación y por tanto su disolución. 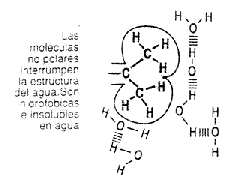 Compuestos orgánicos neutros que poseen grupos funcionales polares (hidroxilo, aldehído cetona, carboxilo, amina, amida, sulfhidrilo); son solubles en el agua, pues no interrumpen su estructura al formar enlaces de hidrógeno con ella. A estos compuestos se les llama hidrófilos o polares.
Compuestos orgánicos neutros que poseen grupos funcionales polares (hidroxilo, aldehído cetona, carboxilo, amina, amida, sulfhidrilo); son solubles en el agua, pues no interrumpen su estructura al formar enlaces de hidrógeno con ella. A estos compuestos se les llama hidrófilos o polares. Compuestos orgánicos no polares (radicales alifáticos); son insolubles en agua porque interrumpen su estructura, al no formar enlaces de hidrógeno con ella. A estos compuestos se les llama hidrófobos o apolares.
 Substancias anfipáticas (poseen a la vez grupos hidrófilos e hidrófobos); son dispersadas por el agua. Por ejemplo, un ácido graso de cadena larga forma unos agregados denominados micelas, en las que los grupos carboxilo polares están en contacto con el agua y forman enlaces hidrógeno con ella, mientras que las cadenas hidrocarbonadas insolubles, hidrófobas y apolares se ocultan del medio acuoso mediante interacciones hidrofóbicas.
Substancias anfipáticas (poseen a la vez grupos hidrófilos e hidrófobos); son dispersadas por el agua. Por ejemplo, un ácido graso de cadena larga forma unos agregados denominados micelas, en las que los grupos carboxilo polares están en contacto con el agua y forman enlaces hidrógeno con ella, mientras que las cadenas hidrocarbonadas insolubles, hidrófobas y apolares se ocultan del medio acuoso mediante interacciones hidrofóbicas. Otra manera de disponerse las substancias anfipáticas cuando se añaden en pequeña cantidad al agua, es formando una monocapa en la superficie, y las cabezas polares se disponen en contacto con la superficie de ésta. Sobre esta monocapa puede disponerse una segunda capa con las colas apolares sobre la primera, formando una bicapa lipídica. En ella las cabezas polares forman enlaces de hidrogeno con el agua y los grupos apolares se mantienen unidos por interacciones hidrofóbicas.
De todo ello, se deduce, que una de las primordiales funciones del agua es la de actuar como disolvente de la mayoría de las moléculas y dado que es condición imprescindible, que para que una reacción química tenga lugar, que los reactivos se encuentren disueltos, podemos deducir que el agua, al permitir la disolución de los compuestos biológicos, actúa como el medio donde se realizan todas las reacciones metabólicas características de la actividad vital.
Así mismo, sirve de vehículo de entrada y salida de las distintas substancias disueltas en ella, a través de la membrana, en la célula.
IONIZACIÓN. REGULACIÓN DEL pH.
Una pequeña parte de las moléculas de agua pueden ionizarse al unirse un átomo de hidrógeno de una molécula al oxigeno de otra molécula, rompiendo su unión con la primera.H H
Aparecen así dos iones de carga opuesta: H3O+ y HO. Habitualmente, los iones H3O+ se representan con H+.
pH = - log [H+]
En el agua destilada la proporción de moléculas ionizadas es muy baja.
A 25º C [H+] x [HO] = 1 * 10-14
A este producto se le denomina producto iónico del agua.
La escala de pH varía entre 1 y 14, correspondiendo el 7 a la neutralidad. Valores por debajo de este corresponden a disoluciones de sustancias ácidas, y si están comprendidos entre 7 y 14, la disolución será básica. En los seres vivos existen disoluciones con un pH determinado, casi siempre próximo a la neutralidad.
LAS SALES MINERALES
Podemos encontrarlas disueltas en los medios celulares internos o externos, o precipitadas en huesos y caparazones. Cuando están disueltas se encuentran disociadas en cationes y aniones. Los principales cationes y aniones presentes en los medios orgánicos son:• Cationes: Na+ , K+ , Ca+2 y Mg+2 .
• Aniones: Cl-, SO4-2, PO4-3, CO3-2, HCO3- y NO3
La proporcion de iones, y sobre todo de cationes, debe mantenerse constante en los medios orgánicos pues ciertos cationes tienen efectos antagónicos. Por ejemplo, el Ca2+ y el K+ tienen funciones antagónicas en el funcionamiento del músculo cardiaco.
PRINCIPALES FUNCIONES DE LAS SALES MINERALES
- Esqueletos y caparazones.- Mantener la salinidad.
- Estabilizar las disoluciones. Por ejemplo, los amortiguadores del pH.
- Especificas: Movimiento muscular, impulso nervioso etc.
GLÚCIDOS
CONCEPTO
Son biomoléculas orgánicas formadas por carbono, hidrógeno y oxígeno.También se incluyen en este grupo moléculas derivadas, con grupos amina, carboxilos, etc, que poseen una gran semejanza química con los glúcidos más comunes.
Atendiendo a su complejidad se clasifican en:
A) Monosacáridos u osas Son los más sencillos. No hídrolizables. Poseen de 3 a 7 átomos de carbono. Constituyen los monómeros a partir de los cuales se originan los demás glúcidos.
B) Ósidos formados por la unión de varios monosacáridos mediante enlaces “O-glucosídicos”, pudiendo poseer en su molécula otros compuestos no glucídicos. Son hidrolizables, descomponiéndose en los monosacárídos y demás compuestos que los constituyen. A su vez se dividen en:
1) Holósidos constituidos exclusivamente por monosacáridos. Si el número de monosacáridos está comprendido entre 2 y 10, se denominan Oligosacáridos, entre ellos cabe destacar a los disacáridos (dos osas) y trisacáridos (tres osas). Pero, sí el número de monosacáridos es superior a 10 se llaman Polisacáridos que pueden estar formados por un solo tipo de osas (homopolisacáridos), o por dos o más tipos (heteropolisacáridos).
2) Heterósidos formados por osas y otros compuestos no glúcidicos de naturaleza variada.
MONOSACÁRIDOS
Como ya se ha dicho, son los glúcidos más sencillos, no hidrolizables y constituyen los monómeros de los demás glúcidos.Propiedades físicas son sólidos, cristalinos, incoloros o blancos, dulces y solubles en agua. Su solubilidad, se debe a que tanto los radicales hidroxilo, como el grupo carbonilo son polares y establecen por ello enlaces de hidrogeno con las moléculas de agua también polares.
Propiedades químicas Poseen poder reductor frente a determinadas sustancias (por ejemplo el licor de Fehling), debido a la presencia del grupo carbonilo que puede oxidarse a ácido con facilidad por disoluciones alcalinas de plata o cobre. Esta propiedad es utilizada para detectar su presencia en medios biológicos.
NATURALEZA QUÍMICA DE LOS MONOSACÁRIDOS
Químicamente están constituidos por una sola molécula de polihidroxialdehido o polihidroxicetona que posee de 3 a 7 átomos de carbono.Su fórmula empírica responde a (CH 2O)n.
La estructura básica de los monosacáridos es una cadena de carbonos no ramificada en la que dichos átomos se encuentran unidos entre sí mediante enlaces covalentes sencillos y todos ellos son portadores de un grupo hidroxilo ( OH) y de un radical de hidrógeno ( H), excepto uno que forma parte de un grupo carbonilo, bien de tipo aldehido o cetona.
Los monosacáridos que poseen un grupo aldehido se denominan aldosas y siempre se encuentra en uno de los carbonos terminales de la molécula. Los que tienen un grupo cetona reciben el nombre de cetosas y siempre se localiza en un carbono intermedio.
Dependiendo de que posean 3, 4, 5 o 6 átomos de carbono, se denominan: triosas, tetrosas, pentosas, hexosas, respectivamente.
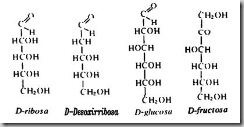
Si tenemos en cuenta ambos criterios para nombrarlos se antepone al sufijo “osa”el prefijo “aldo” o “ceto” para indicar si poseen función aldehido o cetona, seguido de "tri", "tetra", "penta", "hexa" o "hepta", para hacer referencia al número de átomos de carbono que posean. Así por ejemplo un monosacárido de seis átomos de carbono con función aldehido será una aldohexosa. Ejemplos:
HEMIACETAL INTRAMOLECULAR Y CICLACIÓN DE LA MOLÉCULA
Las moléculas de monosacáridos pueden presentar cadenas abiertas, como las que hemos visto hasta ahora, o cerradas, formando ciclos.En las tetrosas, la forma abierta es la que corresponde a su estado en la célula.
Por el contrario, las pentosas y hexosas, cuando se encuentran en disolución acuosa, se comportan como si poseyeran un carbono asimétrico más. Esto es debido a que se forman cadenas cerradas al reaccionar los grupos carbonilo con las moléculas de agua, apareciendo, por tanto, otro carbono asimétrico que presenta un OH llamado hemiacetálico. Por ello existen dos formas distintas en la naturaleza, que por convenio se denominan y , según que el OH hemiacetálico se encuentre a la derecha o a la izquierda del nuevo carbono asimétrico.
Estas moléculas se representan espacialmente:
Ciclación glucosa

Ciclación ribosa

Estos compuestos, por lo anteriormente explicado serán ó , según que el OH hemiacetálico esté representado hacia abajo o arriba del plano.
MONOSACÁRIDOS DE INTERÉS BIOLÓGICO
RIBOSA Aldopentosa. Forma parte de la estructura de los RNA, así como de nucleótidos capaces de transferir energía, como por ejemplo el ATP.
DESOXIRRIBOSA Es un monosacárido que se origina a partir de la ribosa, por perdida del oxígeno del C 2. Forma parte de la estructura del DNA.
GLUCOSA Aldohexosa. Recibe el nombre de azúcar de uva por encontrarse de forma libre en este fruto. Puede encontrarse libre como tal glucosa o formar parte de oligosacáridos y polisacáridos. En nuestra sangre, y procedente de la digestión de los glúcidos que tomamos en el alimento, se encuentra en la proporción de un gramo por litro. Es utilizada como fuente de energía por todas las células, pues es el material energético de uso más inmediato.
FRUCTOSA cetohexosa. Se encuentra en la miel y en la mayoría de los frutos acompañando a la glucosa. En el hígado se transforma en glucosa, por lo que posee para nuestro organismo el mismo valor energético que ésta.
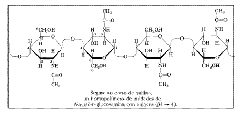
OLIGOSACÁRIDOS
Son glúcidos formados por la unión de dos a diez monosacáridos. Los más abundantes en la naturaleza son los DISACÁRIDOS constituidos por la unión de dos monosacáridos, generalmente hexosas, mediante un enlace "O-glucosídico”.
 Este enlace puede ser ó , dependiendo de la configuración del primer monosacárido.
Este enlace puede ser ó , dependiendo de la configuración del primer monosacárido. Los disacáridos son dulces, solubles en agua, cristalizables y por hidrólisis se descomponen en sus monosacáridos constituyentes.
Entre los disacáridos de mayor interés biológico, se pueden citar como ejemplo

Maltosa formada por dos moléculas de glucosa, unidas mediante un enlace (1-4)
Se obtiene por hidrólisis del almidón y del glucógeno. Aparece durante la germinación de la cebada que se emplea en la fabricación de la cerveza y, una vez tostada como sucedáneo del café (malta).
 Lactosa Formada por una molécula de galactosa y otra de glucosa, unidas mediante un enlace (14). Se encuentra libre en la leche de los mamíferos
Lactosa Formada por una molécula de galactosa y otra de glucosa, unidas mediante un enlace (14). Se encuentra libre en la leche de los mamíferos  Sacarosa formada por una molécula de glucosa y otra de fructosa, unidas por un enlace (12). Es el azúcar común y abunda en la caña de azúcar y en la remolacha azucarera.
Sacarosa formada por una molécula de glucosa y otra de fructosa, unidas por un enlace (12). Es el azúcar común y abunda en la caña de azúcar y en la remolacha azucarera. POLISACÁRIDOS
Son los glúcidos más abundantes en la naturaleza y los de mayor peso molecular.Están formados por más de diez monosacáridos, unidos entre sí mediante enlaces "O-glucosídicos". En la reacción se desprenden tantas moléculas de agua como enlaces forman. Su hidrólisis completa libera monosacáridos. Son insípidos, amorfos e insolubles en agua. Algunos, como el almidón, pueden formar dispersiones coloidales.
Los polisacáridos realizan funciones biológicas de dos tipos: de reserva energética y estructural. Los primeros presentan enlaces de tipo como el almidón y el glucógeno. Los segundos, como la celulosa y la quitina, poseen enlaces de tipo
Los mas frecuentes están formados por hexosas, sobre todo glucosa. o sus derivados. En los vegetales también existen polisacáridos formados por pentosas.
Entre los más importantes se pueden citar:
 Almidón Homopolisacárido, con función de reserva energética, propio de los vegetales, se acumula en el citoplasma celular formando gránulos (amiloplastos), de tamaño y forma característicos de cada especie vegetal. Es especialmente abundante en tubérculos y en semillas.
Almidón Homopolisacárido, con función de reserva energética, propio de los vegetales, se acumula en el citoplasma celular formando gránulos (amiloplastos), de tamaño y forma característicos de cada especie vegetal. Es especialmente abundante en tubérculos y en semillas. Es un polímero de elevado peso molecular formado por miles de moléculas deglucosa, cuya estructura es además de ramificada helicoidal con 6 moléculas de glucosa por vuelta de hélice y las ramificaciones se producen cada 12 moléculas de glucosa.
Glucógeno Homopolisacárido, de reserva energética, propio de los animales. Se acumula en el hígado y en los músculos, donde cuando es necesario se moviliza convirtiéndose en glucosa. Es un polímero de moléculas de glucosa y posee una estructura semejante a la del almidón, con la particularidad de que es aún más ramificado.
 Celulosa Homopolisacárido, con función estructural, exclusivo de las células vegetales, en las que forma la parte fundamental de su pared celular.
Celulosa Homopolisacárido, con función estructural, exclusivo de las células vegetales, en las que forma la parte fundamental de su pared celular. Es un polímero lineal y no ramificado de moléculas de glucosa. Cada molécula de glucosa está girada 180º respecto al residuo adyacente, de modo que el oxígeno de cada anillo establece un puente de hidrógeno con el grupo OH del C3 del anillo siguiente, lo que impide la formación de estructuras helicoidales, obteniéndose de este modo una cadena recta y extendida. Varias cadenas adyacentes, con esta conformación, pueden establecer, entre ellas, enlaces de hidrógeno, dando como resultado la formación de fibras con una elevada fuerza tensil
Sin embargo, los enlaces del almidón y del glucógeno originan una estructura muy distinta.
La celulosa se hidroliza por acción de las "celulasas" capaces de romper los enlaces dando moléculas de celobiosa y estas finalmente glucosa. Solo algunos microorganismos, como protozoos y bacterias sirnbióticos del aparato digestivo de animales herbívoros y de insectos xilófagos poseen dicho enzima.
Quitina
Homopolisacárido con función estructural que forma la parte fundamental del exoesqueleto de los artrópodos.FUNCIONES:
Los glúcidos desempeñan las siguientes funciones biológicas:Energética: Constituyen el material energético de uso inmediato para los seres vivos. El glúcido más utilizado por todo tipo de células como fuente de energía es la glucosa (su oxidación libera 4,1Kcal/g). Otros glúcidos, como el almidón, el glucógeno, la sacarosa, la lactosa....... son formas de almacenar glucosa. Así el glucógeno y el almidón permiten acumular miles de moléculas de glucosa en animales y vegetales respectivamente. Estas moléculas al ser bastante insolubles en agua pueden almacenarse en grandes cantidades.
Por otra parte y dado que los glúcidos son los primeros productos obtenidos durante la fotosíntesis, constituyen una fuente de carbono para los demás compuestos orgánicos.
Estructural algunos glúcidos forman parte de estructuras celulares y de tejidos. Entre los glúcidos que desempeñan esta función se pueden citar: la celulosa, la pectina y la hemicelulosa que constituyen la pared celular de las células vegetales; los peptidoglicanos constituyentes de la pared bacteriana; la quitina que forma el exoesqueleto de los artrópodos; la ribosa y desoxirribosa componentes de la estructura de los RNA y DNA respectivamente.
Los glúcidos (oligosacáridos)unidos covalentemente a las proteínas o a los lípidos de las membranas celulares, actúan como receptores de membrana de muchas sustancias y lugares de reconocimiento entre células del mismo tejido.
LÍPIDOS
CONCEPTO
Son biomoléculas orgánicas, compuestas básicamente por carbono, hidrógeno y oxígeno y, en determinadas ocasiones también por otros elementos, como fósforo, nitrógeno y azufre.Constituyen un grupo de moléculas muy heterogéneas, que tienen en común dos características:
ser insolubles en agua y otros disolventes polares.
ser solubles en disolventes orgánicos, es decir, no polares, como el benceno, el cloroformo, la acetona, el éter, etc.
Desde el punto de vista químico, se pueden clasificar teniendo en cuenta diversos criterios. Uno de ellos es, en función de sus relaciones con los ácidos grasos. Según este criterio, los lípidos se dividen en:
con ac. grasos Esfingofosfolípidos Lípidos de
Glicolípidos Esfingoglicolípidos membrana
Colesterol
Insaponificables Vitaminas
sin ac. grasos Terpenos
Prostaglandinas
ÁCIDOS GRASOS
Son moléculas que poseen una larga cadena lineal hidrocarbonada, generalmente con un número par de átomos de carbono (14 a 22) y con un grupo carboxilo en uno de sus extremos:R COOH, R, cadena hidrocarbonada saturada
Acido pálmitico: CH3 (CH2)14 COOH
R’ COOH, R´, cadena hidrocarbonada no saturada
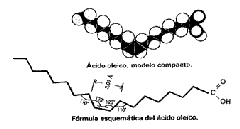 |
Acido oléico: CH3 (CH2)7 CH = CH (CH2)7 COOH
No suelen encontrarse en estado libre y se obtienen mediante hidrólisis ácida o enzimática de otros lípidos.
Los ácidos grasos se diferencian unos de otros en:
· longitud de la cadena hidrocarbonada.
· presencia o ausencia de dobles enlaces en dicha cadena, así como en el número y posición que ocupan.
En función de estos dobles enlaces, los ácidos grasos se clasifican en:
Saturados son aquellos que poseen únicamente enlaces covalentes sencillos. En estos compuestos, la rotación libre alrededor de cada enlace carbonocarbono, confiere gran flexibilidad a la cadena hidrocarbonada, que puede adoptar muchas conformaciones diferentes, siendo la más estable la totalmente extendida.
Son ejemplos de ácidos grasos saturados entre otros: ácido palmítico: CH3 (CH2)14 COOH, el esteárico, etc.
Insaturados Son aquellos que poseen uno o varios dobles enlaces. Estos dobles enlaces al ser rígidos y carecer de libertad de giro provocan inflexiones de la cadena hidrocarbonada. Como ejemplo se puede citar el ácido oleico que se encuentra en el aceite de oliva
Cuando poseen varios dobles enlaces, en la cadena hidrocarbonada, se denominan poliinsaturados.
PROPIEDADES FÍSICAS DE LOS ÁCIDOS GRASOS
Las propiedades físicas de los ácidos grasos y de los compuestos que los contienen vienen determinadas en gran medida por la longitud y grado de insaturación de la cadena hidrocarbonada.Solubilidad Los ácidos grasos son compuestos anfipáticos, ya que poseen una zona hidrófoba, la cadena hidrocarbonada, con tendencia a formar enlaces de Van der Waals con otras cadenas semejantes. Por el contrario el grupo carboxilo es polar e hidrófilo. Debido a ello los ácidos grasos cuando se encuentran en un medio acuoso sus grupos hidrófilos se orientan hacia las moléculas de agua, mientras que los grupos hidrófobos se alejan de ellas, dando lugar a la formación de micelas, monocapas y bicapas
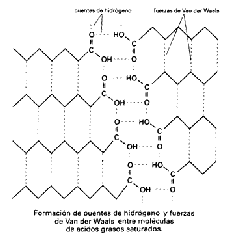 Punto de fusión Los ácidos grasos saturados, debido a su conformación totalmente extendida pueden empaquetarse estrechamente, lo que permite la formación de un gran número de fuerzas de Van der Waals entre los átomos de cadenas hidrocarbonadas vecinas (el número de estos enlaces está en relación directa con la longitud de la cadena). Por el contrario en los ácidos grasos insaturados, los doblamientos provocados por los dobles enlaces de la cadena hidrocarbonada no permiten este empaquetamiento tan fuerte, por lo que las interacciones de Van der Waals son más débiles, necesitándose menos energía para romperlas. Por ello los ácidos grasos insaturados tienen puntos de fusión más bajos que los saturados de la misma longitud de cadena, esto determina que a temperatura ambiente los saturados sean sólidos, mientras que los insaturados son líquidos.
Punto de fusión Los ácidos grasos saturados, debido a su conformación totalmente extendida pueden empaquetarse estrechamente, lo que permite la formación de un gran número de fuerzas de Van der Waals entre los átomos de cadenas hidrocarbonadas vecinas (el número de estos enlaces está en relación directa con la longitud de la cadena). Por el contrario en los ácidos grasos insaturados, los doblamientos provocados por los dobles enlaces de la cadena hidrocarbonada no permiten este empaquetamiento tan fuerte, por lo que las interacciones de Van der Waals son más débiles, necesitándose menos energía para romperlas. Por ello los ácidos grasos insaturados tienen puntos de fusión más bajos que los saturados de la misma longitud de cadena, esto determina que a temperatura ambiente los saturados sean sólidos, mientras que los insaturados son líquidos. PROPIEDADES QUIMICAS DE LOS ACIDOS GRASOS
Por poseer un grupo carboxilo pueden llevar a cabo:Reacciones de esterificación en las que reaccionan con grupos alcohólicos formando ésteres:
R COOH + HONa ® H2O + R COONa
ACILGLICÉRIDOS O GRASAS
Son ésteres formados por una molécula de glicerina y una, dos o tres moléculas de ácidos grasos. En el primer caso se denominan monoacilglicéridos, en el segundo diacilglicéridos y en el tercero triacilglicéridos.Entre ellos cabe destacar los triacilglicéridos denominados también triglicéridos, grasas o grasas neutras.
 |
Si los tres ácidos grasos son iguales, el triacilglicérido se denomina simple y si no lo son, recibe el nombre de mixto. Las grasas naturales suelen ser mezcla de ambos.
Si los ácidos grasos que predominan son insaturados es líquido y se denomina aceite. si predominan los saturados es sólido y recibe el nombre de sebo. En los animales poiquilotermos y en los vegetales hay aceites y en los animales homeotermos hay sebos.
Los triacilglicéridos se hidrolizan a pH neutro por acción de las lipasas, rindiendo una molécula de glicerina y tres de ácidos grasos. Las lipasas del intestino colaboran en la digestión y absorción de las grasas de la dieta.
También se hidrolizan hirviéndolos con soluciones diluidas de hidróxido sódico o hidróxido potásico, esta reacción de saponificación origina glicerina y las sales sódicas o potásicas de los ácidos grasos correspondientes denominadas jabones.
Las grasas, como ya se ha dicho, son moléculas de reserva energética. Se almacenan en las vacuolas de las células vegetales (sobre todo en frutos y semillas de las plantas oleaginosas) y en los adipocitos del tejido adiposo de los animales.
Son mas apropiadas que el glucógeno como reserva energética, ya que no sólo pueden almacenarse en grandes cantidades sino que lo hacen en forma casi deshidratada, con lo que ocupan menos volumen.
En algunos animales, las grasas acumuladas debajo de la piel sirven también de aislante térmico.
CERAS
Resultan de la esterificación de un monoalcohol lineal de cadena larga con un ácido graso también de cadena largaFOSFOLÍPIDOS
Son lípidos que forman parte de todas las membranas celulares. Derivan del glicerol, o de la esfingosina, un alcohol más complejo. Los derivados del glicerol se denominan Fosfoglicéridos y los derivados de la esfingosina, Esfingolípidos. |
FOSFOGLICÉRIDOS (GLICEROFOSFOLÍPIDOS) Su estructura molecular deriva de la unión de un ácido fosfatídico con un compuesto polar, generalmente aminoalcohol.
El ácido fosfatídíco es un triester de glicerol con dos ácidos grasos (posiciones 1 y 2) y un ácido ortofosfórico (posición 3)
El ácido graso que se esterifica con el primer OH del glicerol suele ser saturado y el segundo insaturado.
El compuesto polar (HO X) se une al ácido fosfatídico, a nivel del ácido ortofosfórico, mediante una nueva reacción de esterificación.
 Dado que el ácido ortofosfórico esterifica a dos grupos hidroxilo, se dice que forma un enlace fosfodiéster.
Dado que el ácido ortofosfórico esterifica a dos grupos hidroxilo, se dice que forma un enlace fosfodiéster. Existen varias clases de fosfoglicéridos, dependiendo del compuesto polar. Como ejemplo se pueden citar la Lecitina (fosfatidilcolina), que se encuentra en la mayoría de las membranas celulares de los organismos superiores, y cuyo grupo polar es la colina:
 Todos los fosfoglicéridos son compuestos anfipáticos, poseen dos cadenas apolares, hidrófobas (cadenas hídrocarbonadas de los ácidos grasos) y un grupo polar hidrófilo (resto de la molécula). Debido a este carácter anfipático desempeñan una función estructural, siendo constituyentes esenciales de todas las membranas celulares.
Todos los fosfoglicéridos son compuestos anfipáticos, poseen dos cadenas apolares, hidrófobas (cadenas hídrocarbonadas de los ácidos grasos) y un grupo polar hidrófilo (resto de la molécula). Debido a este carácter anfipático desempeñan una función estructural, siendo constituyentes esenciales de todas las membranas celulares. ESFINGOLIPIDOS
Su estructura molecular deriva de la unión del alcohol esfingosina, un ácido graso y un grupo polar que puede ser un aminoalcohol o un glúcido.De todos ellos el más conocido es la esfingomielina
 Al igual que los fosfoglicéridos, son compuestos anfipáticos pues poseen un grupo polar y dos cadenas apolares hidrófobas (cadena hidrocarbonada de la esfingosina y del ácido graso), por lo que desempeñan también una función estructural como constituyentes de las membranas celulares
Al igual que los fosfoglicéridos, son compuestos anfipáticos pues poseen un grupo polar y dos cadenas apolares hidrófobas (cadena hidrocarbonada de la esfingosina y del ácido graso), por lo que desempeñan también una función estructural como constituyentes de las membranas celulares ESTEROIDES
Derivan de un hidrocarburo cíclico el esterano o ciclopentano perhidrofenantreno.Esteroles: Son los esteroides entre los que cabe destacar el colesterol presente en la mayoría de las células eucarióticas. Poseen en el carbono 3 el grupo OH y en el carbono 17 una cadena hidrocarbonada.
Es un compuesto anfipático, ya que posee un grupo polar, hidrófilo (el grupo OH), mientras que el resto de la molécula es apolar, hidrófobo. Este carácter anfípático le permite desempeñar una función estructural, siendo componente muy importante de las membranas de las células animales, a las que confiere estabilidad y fluidez.
El colesterol, además de su papel como constituyente de membranas, es el precursor de otros esteroides, entre los que destaca también la vitamina D, los ácidos biliares y las hormonas sexuales.
FUNCIONES
Los lípidos desempeñan entre otras, las siguientes funciones biológicas:1. Energética Tal es el caso de las grasas, que al ser moléculas muy poco oxidadas poseen un alto contenido energético. Por ejemplo la oxidación de un gramo de grasa libera 9,4 Kcal., más del doble de la que se consigue con la oxidación de un gramo de glúcidos o de proteínas (4,1 Kcal).
Las grasas acumuladas en el tejido adiposo de los animales además de constituir una reserva energética para el organismo, son un poderoso aislante térmico y en ocasiones mecánico, como por ejemplo la grasa que rodea a los riñones.
2. Estructural Los fosfolípidos, esfingoglicolípidos y el colesterol, dada su naturaleza polar forman parte de las membranas celulares.
3. Protectora Función desempeñada por las ceras al impermeabilizar las superficies en que se depositan.
4. Transportadora Por ejemplo los ácidos y las sales biliares que dispersan las grasas facilitando su degradación y posterior absorción intestinal.
5. Reguladora Contribuyendo al normal funcionamiento del organismo. Desempeñan esta función las vitaminas lipídicas (A, D, K, E), así como las hormonas sexuales y hormonas suprarrenales, de carácter también lipídico.
CARÁCTER ANFIPÁTICO DE LOS LÍPIDOS. LÍPIDOS DE MEMBRANA.
Los lípidos que constituyen las membranas celulares tienen en común una característica muy importante: son moléculas anfipáticas. Contienen a la vez una parte hidrofílica, que se siente atraída por el agua y otra hidrofóbica que huye del agua. Los principales lípidos de membrana son: fosfolípidos (más abundantes), glicolípidos y colesterol.| Lípido de membrana | Unidad hidrofóbica | Unidad hidrofílica |
| Fosfoglicéridos | Cadenas de ácidos grasos | Alcohol fosforilado |
| Esfingomielina | Cadena de ácido graso y cadena hidrocarbonada de esfingosina. | Fosforilcolina |
| Glicolípidos | Cadena de ácido graso y cadena hidrocarbonada de esfingosina | Uno o más residuos de azúcar |
| Colesterol | Molécula completa excepto el grupo OH | Grupo OH en C3 |
Es evidente que cuando estos lípidos se encuentran en medio acuoso (como ya estudiamos) sus cabezas polares tendrán afinidad por el agua mientras que las colas hidrocarbonadas evitarán el agua. Esto puede conseguirse formando una micela en la que los grupos polares están en la superficie y las colas hidrocarbonadas quedan inmersas en el interior de la micela.
 Sin embargo, la ordenación que satisface tanto las preferencias hidrofóbicas como hidrofílicas, de la mayoría de los fosfolípidos y glicolípidos en medios acuosos es la de la bicapa lipídica (una capa bimolecular de lípidos).
Sin embargo, la ordenación que satisface tanto las preferencias hidrofóbicas como hidrofílicas, de la mayoría de los fosfolípidos y glicolípidos en medios acuosos es la de la bicapa lipídica (una capa bimolecular de lípidos). La razón es que sus colas de ácidos grasos los hacen demasiado voluminosos para acumularse en el interior de la micela. Además una micela es una estructura limitada, en contraposición con una bicapa lipídica que puede tener dimensiones macroscópicas de hasta 1 mm. (107 Å). Por ello, al poder formar capas bimoleculares extensas, son los constituyentes claves de las membranas. Además estas películas sirven como barreras de permeabilidad, a pesar de ser estructuras bastantes fluidas.
La formación de estas bicapas de fosfolípidos y glicolípidos, como consecuencia de su carácter anfipático, es un proceso de autoensamblaje o autoasociación, rápido y espontáneo en el agua.
Las principales fuerzas que determinan la formación de bicapas son las interacciones hidrofóbicas originadas al liberarse las moléculas de agua de las colas hidrocarbonadas a medida que estas colas quedan secuestradas en el interior apolar de la bicapa. Además, entre estas colas hidrocarbonadas existen fuerzas de Van der Waals que favorecen su empaquetamiento compacto. Finalmente, se producen interacciones favorables, electrostáticas y de enlace de hidrógeno entre los grupos polares de la cabeza y las moléculas de agua.
Por tanto, las bicapas lipídicas están estabilizadas por todo el conjunto de fuerzas que intervienen en las interacciones moleculares de los sistemas biológicos.
Las bicapas lipídicas tienden a cerrarse sobre si mismas de tal manera que no existan extremos con cadenas hidrocarbonadas expuestas al agua, lo que da como resultado la formación de un compartimento. Además, las bicapas lipídicas se autorreparan puesto que un orificio en la bicapa es energéticamente desfavorable.
LOS PRÓTIDOS
CONCEPTO DE PROTEÍNA
Podemos definirlas como polímeros formados por la unión, mediante enlaces peptídicos, de moléculas de baja masa molecular llamadas aminoácidos.Son macromoléculas muy complejas, de elevada masa molecular (entre 6000 y 106 u[1].). Algunas proteínas están constituidas por un solo polímero de aminoácidos pero otras son grandes edificios moleculares formados por varios polímeros ensamblados que además, en ciertas ocasiones, se encuentran unidos a otras moléculas orgánicas (lípidos y glúcidos principalmente).
Son las moléculas orgánicas más abundantes en las células, más del 50% del peso seco de una célula es materia proteica. Básicamente están formadas por C, H, O y N, aunque casi todas contienen además S. Otros bioelementos que con frecuencia forman parte de los prótidos son: P, Fe, Zn y Cu. De todos estos elementos el más característico de las proteínas es el N, son los compuestos nitrogenados por excelencia de todos los seres vivos.
Las funciones más importantes y específicas de la materia viva son realizadas por proteínas o por moléculas complejas en cuya composición encontramos alguna proteína.
Las proteínas son las moléculas específicas que marcan la individualidad de cada ser vivo. Además son las moléculas mediante las que se expresa la información genética, de hecho el dogma central de la genética molecular nos dice:
LOS AMINOÁCIDOS
 Son las unidades estructurales que constituyen las proteínas, los monómeros que, enlazados y repetidos muchas veces, forman los distintos tipos de proteínas.
Son las unidades estructurales que constituyen las proteínas, los monómeros que, enlazados y repetidos muchas veces, forman los distintos tipos de proteínas. Químicamente son ácidos orgánicos que llevan además del grupo carboxílico, un grupo amino. En los aminoácidos que se encuentran en las proteínas de los seres vivos el grupo amino está siempre en posición alfa, por este motivo solemos referirnos a los aminoácidos con el símbolo aa . Todos los aminoácidos que se encuentran en las proteínas, salvo la prolina, responden a la fórmula general expresada al margen.
En la fórmula general R representa el radical o "resto" de la molécula, lo que diferencia a unos aminoácidos de otros. La R puede ser un simple H o algo más complejo como un anillo hexagonal, una corta cadena alifática, etc. En las proteínas naturales encontramos 20 aminoácidos diferentes que son prácticamente los mismos para todos los seres vivos.
Clasificación de los aminoácidos
Podemos clasificar los aminoácidos fijándonos en el radical, si tiene carácter polar o no polar y en su carga eléctrica, pero también podríamos tener en cuenta otros criterios, casi todos ellos en función de los radicales. Una clasificación sencilla podría ser la siguiente:| Grupo I | Radical neutro y apolar, es una cadena hidrófoba. Hidrófobos. |
| Grupo II | Radical neutro y polar que son capaces de formar puentes de hidrógeno con el agua porque poseen un grupo alcohólico, un grupo sulfhídrico o una amida. Hidrófilos. |
| Grupo III | Radical básico y por tanto con carga positiva, contiene uno o más grupos aminos. Hidrófilos. |
| Grupo IV | Radical ácido y por tanto con carga negativa, contiene un grupo ácido. Hidrófilos. |
El enlace peptídico
Se trata de un enlace que se establece entre el grupo carboxilo de un aminoácido y el grupo amino de otro. La configuración espacial de este enlace es tal, que los átomos del grupo carboxílico y del grupo amino se sitúan en un mismo plano con ángulos y distancias fijos. Este enlace tiene ciertas características que convienen remarcar:
Este enlace tiene ciertas características que convienen remarcar: Es un enlace covalente muy resistente, lo que hace posible el gran tamaño y estabilidad de las moléculas proteicas.
En cierto modo se comporta como un doble enlace, tiene una cierta rigidez e impide el giro libre a su alrededor.
Inmoviliza en un plano a los cuatro átomos que lo integran. Las distancias y los ángulos entre estos cuatro átomos se mantienen constantes.
Es el enlace mediante el cual se encadenan los aminoácidos para formar polímeros llamados péptidos: dipéptidos, tripéptidos, tetrapéptidos, polipéptidos.

LOS PÉPTIDOS
Están formados por la unión de aminoácidos mediante enlaces peptídicos. Si el número de aminoácidos es inferior a diez, oligopéptido; si es mayor de diez, polipéptido. Si el polipéptido tiene más de cien aminoácidos o un peso molecular superior a 5.000, se denomina proteína.Un ejemplo de péptido bien conocido es la insulina (dos cadenas de 21 y 30 aminoácidos unidos por dos puentes disulfuro entre cisteinas), la encefalina (5 aminoácidos) que se produce en las neuronas cerebrales y elimina la sensación de dolor y la oxitocina (9 aminoácidos) de la hipófisis que produce las contracciones del útero durante el parto.
ESTRUCTURA DE PROTEÍNAS
Distinguimos dos grandes grupos de prótidos: las holoproteínas, que están formadas exclusivamente por aminoácidos; y las heteroproteínas, que están formadas por holoproteínas asociadas a alguna otra molécula no proteica como puede ser un glúcido, un lípido, un ác. nucleico, etc.La conformación de una proteína es la disposición que adopta la molécula en el espacio. En condiciones normales de pH y temperatura, las cadenas peptídicas suelen poseer una única conformación que será la responsable de sus funciones biológicas.
La estructura o conformación de las proteínas es tan complicada que para estudiarla lo hacemos a diferentes niveles de complejidad.
A) La estructura primaria.
Se refiere a la secuencia u orden que siguen los aminoácidos.Toda cadena polipeptídica está polarizada, esto es, posee dos extremos bien definidos. Llamamos extremo Nterminal al extremo donde se encuentra el aminoácidos con el grupo amino libre, llamamos extremo Cterminal al extremo en el que se encuentra el aminoácidos con el grupo carboxílico libre. Al enumerar los aminoácidos de una proteína lo haremos desde el extremo Nterminal hacia el Cterminal:
NH2GlyGlyLys .......ValLeuCOOH
La estructura primaria es de gran importancia porque de ella van a depender todos los demás niveles estructurales. La alteración de la secuencia de aminoácidos de un polipéptido dará lugar a una proteína diferente que puede incluso perder toda actividad biológica o realizar una función diferente de la original.
Dos polipéptidos son diferentes aunque tengan exactamente los mismos aminoácidos si éstos están dispuestos en orden diferente.
B) La estructura secundaria.
Es la disposición de la secuencia de aminoácidos o estructura primaria en el espacio, sobre todo dependerá de la disposición regular y repetida de los radicales R.La estabilidad de esta estructura se debe a la capacidad de giro de los enlaces (de todos excepto de los enlaces peptídicos) y a la formación de puentes de hidrógeno entre los:
C = O :::::: H N
Se conocen básicamente tres tipos de estructuras secundarias:
La alfahélice, la hélice de colágeno y la disposición beta o de lámina plegada.
* AlfaHélice. En la conformación de la estructura secundaria en Alfahélice, la cadena de aminoácidos se enrolla sobre sí misma, en forma de hélice que gira hacia la derecha, debido a la especial disposición en que se van orientando los aminoácidos al enlazarse y que determina que cada plano que contiene un enlace peptídico realice un giro determinado respecto al plano anterior. Los puentes de hidrógeno que se establecen entre los: C = O :::::: H N de los enlaces peptídicos no consecutivos son los responsables de la estabilidad de esta estructura.[2]
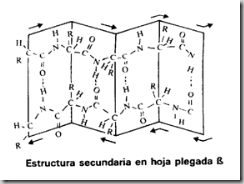
* La disposición beta o en lámina plegada, el plegamiento forma una especie de fuelle o lámina plegada en zig-zag origiunada por la unión de varios segmentos de la misma cadena o de cadenas distintas, por medio de puentes de hidrógeno transversales entre los N-H y los C=O de los enlaces peptídicos. Los radicales (R) de los aminoácidos, aparecen situados por encima y por debajo de esta lámina plegada.
C) Estructura terciaria
Es la disposición que adquiere en el espacio la estructura secundaria.Conjunto de plegamientos característicos que se produce por la unión entre los radicales R de los aminoácidos.

Una secuencia de aminoácidos en disposición alfa o beta, normalmente no se dispone en línea recta, sino que se dobla o retuerce, adquiriendo lo que llamamos estructuras terciarias.
Básicamente distinguimos dos tipos de estructuras terciarias: la filamentosa y la globular. También es cierto que para muchos autores la estructura filamentosa es la ausencia de estructura terciaria.
Las proteínas con conformación filamentosa o fibrosa, suelen ser estructurales, de protección o ambas cosas a la vez. Mantienen la disposición alargada y no se retuercen y por este motivo podemos decir que carecen de estructura terciaria. Son insolubles en agua y soluciones salinas: betaqueratina, colágeno, elastina, etc.
Las proteínas que realmente adquieren estructuras terciarias con pliegues, repliegues y dobleces son las proteínas con conformación globular. Suelen ser dinámicas o dinámicoestructurales, la estructura secundaria se dobla y retuerce varias veces hasta adquirir una forma más o menos globular o esférica, son solubles en agua y/o disoluciones salinas.
Los tramos rectos de las proteínas globulares generalmente tienen estructura secundaria en alfahélice, los tramos donde dobla la cadena polipeptídica tienen disposición beta.
Son globulares, por ejemplo, los enzimas, las proteínas de membrana, muchos transportadores, etc.
En una proteína globular pueden existir diferentes segmentos de alfahélices y/o de láminas beta, pero siempre se encuentran las formas beta en el centro y las formas alfahélice en la superficie. Por otra parte el polipéptido siempre se dobla de manera que los radicales hidrófobos quedan en el centro del glóbulo y los hidrófilos en la superficie excepto en el caso de las proteínas de membrana que, al estar inmersas en un ambiente lipídico, disponen sus radicales hidrófobos en la superficie.
Estas estructuras globulares se forman y se mantienen debido a la presencia de:
* Enlaces covalentes fuertes entre los radicales de los aminoácidos, como los puentes disulfuro que se establecen entre dos aminoácidos con azufre (cisteinas y metioninas)
* Otros enlaces débiles como puentes de hidrógeno, Van der Waals, interacciones eléctricas, interacciones ácidobase e interacciones hidrofóbicas.
D) Estructura cuaternaria
Cuando varias cadenas de aminoácidos, iguales o diferentes, se unen para formar un edificio proteico de orden superior, se disponen según lo que llamamos estructura cuaternaria. También se considera estructura cuaternaria la unión de una o varias proteínas a otras moléculas no proteicas para formar edificios macromoléculares complejos.Cada polipéptido que interviene en la formación de este complejo proteico es un protómero y según el número de protómeros tendremos: dímeros, tetrámeros, pentámeros, etc.
La asociación o unión de las moléculas que forman una estructura cuaternaria, se consigue y mantiene mediante enlaces de hidrógeno, fuerzas de Van der Waals, interacciones electrostáticas y algún que otro puente disulfuro.
Un ejemplo de estructura cuaternaria es la hemoglobina, formada por las globinas o parte proteica (dos cadenas alfa y dos cadenas beta) más la parte no proteica o grupos Hemo.
 La conformación espacial cuaternaria de los prótidos es la responsable de su actividad biológica, esta función se puede ver alterada cuando hay modificación de la secuencia de aminoácidos o estructura primaria: en el caso de la anemia falciforme, el aminoácido nº 6 de las cadenas b (el glutámico) es sustituido por la valina, como consecuencia de esto se produce un ensamblaje anormal de los componentes de la hemoglobina que tiene como consecuencia la perdida de su funcionalidad; transporta menor cantidad de O2 y los eritrocitos adoptan forma de hoz.
La conformación espacial cuaternaria de los prótidos es la responsable de su actividad biológica, esta función se puede ver alterada cuando hay modificación de la secuencia de aminoácidos o estructura primaria: en el caso de la anemia falciforme, el aminoácido nº 6 de las cadenas b (el glutámico) es sustituido por la valina, como consecuencia de esto se produce un ensamblaje anormal de los componentes de la hemoglobina que tiene como consecuencia la perdida de su funcionalidad; transporta menor cantidad de O2 y los eritrocitos adoptan forma de hoz. En el esquema anterior se pueden comparar y diferenciar con claridad los cuatro niveles estructurales que acabamos de estudiar.
PROPIEDADES DE LAS PROTEÍNAS
Las propiedades de una proteína, incluso su carga eléctrica, dependen de los restos o radicales de los aminoácidos que quedan en su superficie y que podrán interaccionar mediante enlaces covalentes o no covalentes con otras moléculas. A continuación veremos las propiedades más importantes:* Solubilidad.
Las proteínas (sobre todo las globulares) en soluciones acuosas forman dispersiones coloidales debido a la polaridad de algunos radicales hidrófilos de los aminoácidos que se quedan dispuestos en la periferia de la molécula. Cada macromolécula proteica queda rodeada de moléculas de agua y no contacta con otras macromoléculas gemelas con lo que no puede producirse la precipitación.* Desnaturalización.
Las alteraciones de la concentración, del grado de acidez, de la temperatura (calor); provocan la pérdida de solubilidad de las proteínas y la consecuente precipitación. A todo este proceso lo llamamos desnaturalización.Esto es debido a la desaparición de los enlaces débiles tipo puente de hidrógeno, Van der Waals, etc. y en realidad no afecta a los enlaces peptídicos y por tanto a la estructura primaria. Sin embargo al ver alterada su conformación espacial, la proteína perderá su funcionalidad biológica.
Puede existir una renaturalización casi siempre, excepto cuando el agente causante de la desnaturalización es el calor (coagulación de la leche, huevos fritos, "permanente" del cabello, etc.).
* Especificidad.
En las proteínas existen sectores fijos que tienen siempre la misma secuencia de aminoácidos sin que se altere la función biológica de la proteína. Este hecho da lugar a que a lo largo de la evolución se desarrollen infinidad de moléculas proteicas diferentes para cumplir la misma función y por la tanto a que cada especie, o incluso cada individuo, tenga sus propias proteínas específicas.La especificidad de las proteínas dependerá por lo tanto de los sectores variables y a ellos se deben, por ejemplo, los problemas de rechazos en los transplantes de órganos.
Por ejemplo: La insulina consta de 51 aminoácidos en todos los mamíferos, que están distribuidos en dos cadenas, de 21 y 30 aminoácidos respectivamente, unidas mediante dos enlaces disulfuro; de éstos 51 aminoácidos, la mayoría son los mismos en todas las especies, pero unos pocos (tres de la cadena corta) varían de unas a otras.
CLASIFICACIÓN DE LAS PROTEÍNAS EN FUNCIÓN DE SU ACTIVIDAD BIOLÓGICA.
De entre las funciones generales más características que las proteínas cumplen en las células podemos destacar las de tipo enzimático, estructural, contráctil, transporte, hormonal e inmunológico.Estas funciones no son excluyentes entre sí, de tal manera que, por ejemplo, una proteína puede ser al mismo tiempo estructural y enzimática, como ocurre con muchos enzimas que forman parte de las membranas celulares.
Si atendemos a su actividad biológica, y aunque muchas proteínas cumplen más de una función, podemos establecer la siguiente clasificación:
* De reserva. En general las proteínas no tienen función de reserva, pero pueden utilizarse con este fin en algunos casos especiales como por ejemplo en el desarrollo embrionario: ovoalbúmina del huevo, caseína de la leche y gliadina del trigo.
* Estructural. Son un material de suma importancia que es utilizado en casi todas las estructuras celulares como membranas, material extracelular, complejos macromoleculares, asociadas al ADN, citoesqueletos, fibras del huso acromático, cilios y flagelos, ribosomas, etc.
Ej. : glucoproteínas de la membrana plasmática, Histonas, colágeno (tejs. conectivos, tendones, hueso, cartílago, etc.), elastina (ligamentos, paredes de los vasos sanguíneos, tej, conjuntivo), queratina (en la epidermis, pelos, plumas, uñas, cuernos, escamas), fibroína (en los artrópodos, tela de araña, capullo de seda de las larvas de las mariposas).
* Homeostática. En el medio interno celular y extracelular mantienen el equilibrio osmótico.
* De transporte. Además de las proteínas de transporte que se encuentran en todas las membranas, otras proteínas transportan sustancias por los medios internos.
Como ejemplos podemos recordar: Hemoglobina que transporta O2 en la sangre de los vertebrados; hemocianina que transporta O2 en los invertebrados y mioglobina que hace lo mismo en los músculos estriados; citocromos que transportan electrones en la cadena respiratoria y en la fase luminosa de la fotosíntesis, las lipoproteínas que transportan lípidos, etc.
* Inmunológica y defensiva. Como ejemplos de este tipo de proteínas tenemos:
Trombina y fibrinógeno que son responsables de la coagulación de la sangre, mucinas germicidas y protectoras de las mucosas digestivas y respiratorias, inmunoglobulinas o anticuerpos sanguíneos que bloquean la acción de los antígenos.
* Hormonal. Como ejemplos de esta funcionalidad proteica tenemos:
Insulina que aumenta la permeabilidad para la glucosa de las membranas plasmáticas, glucagón que es antagónico de la insulina, somatotropa u hormona del crecimiento, etc.
* Contráctil. Debida a la posibilidad que tienen algunas para cambiar de forma manteniendo su estabilidad.
Ejemplos típicos son: la actina y la miosina, responsables de la contracción muscular, la dineína de los cilios y flagelos, tubulinas de los microtúbulos y micrifibrillas, etc.
* Enzimática. Quizás la función más específica e importante de las proteínas. Los enzimas que controlan el metabolismo celular son de naturaleza proteica.
ÁCIDOS NUCLÉICOS
Estructura química de los ácidos nucleicos:
Conceptos generales:
Los ácidos nucleicos son biomoléculas responsables de las funciones de los seres vivos, ya que contienen los mensajes y las instrucciones para llevar a cabo todos los procesos vitales. Lo que un individuo es o puede llegar a ser está determinado por sus ácidos nucleicos. Se puede decir que son los depositarios del guión de la historia que tiene lugar en la célula. Químicamente estas macromoléculas son polímeros de elevado peso molecular cuyo monómero se denomina NUCLEÓTIDO.
 Constituidos por 5 bioelementos fundamentales: C, H, O, N, P
Constituidos por 5 bioelementos fundamentales: C, H, O, N, P Por hidrólisis originan ácido ortofosfórico, una pentosa y bases nitrogenadas.
Existen dos tipos: ARN y ADN
 Las pentosas posibles son la RIBOSA o la DESOXIRRIBOSA.
Las pentosas posibles son la RIBOSA o la DESOXIRRIBOSA. Las bases nitrogenadas pueden ser:
Púricas: Derivan de la PURINA y son dos A, Adenina y G, Guanina.
Pirimidínicas: Derivan de la PIRIMIDINA y son tres T, timina, C, citosina, U, Uracilo.
NUCLEÓSIDO = Pentosa + Base nitrogenada.
NUCLEÓTIDO = NUCLEÓSIDO + ácido ortofosfórico.
 ÁCIDO NUCLEICO = POLINUCLEÓTIDO.
ÁCIDO NUCLEICO = POLINUCLEÓTIDO. 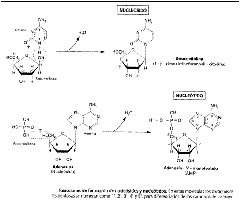
El enlace: Nglucosídico entre el Carbono 1 de la pentosa y el N de la base (N 1 si es pirimidínica, N 9 si es púrica).
LOS NUCLEÓTIDOS.
Son ésteres fosfóricos de nucleósidos.Nucleósido + PO4H3. Se unen en el Carbono 5 de la pentosa.
Los nucleótidos además de actuar como monómeros de los ácidos nucleicos llevan a cabo otras funciones importantes en la célula:
· Son portadores de la energía química, como por ej. el ATP, el GTP...
· Son componentes de cofactores enzimáticos como en el caso del Coenzima A, en el que parecen actuar como asidero de fijación que ayuda a tirar del sustrato para colocarlo en el centro activo del enzima.
· Son intermediarios de la comunicación celular, como los AMPcíclicos o adenilciclasas que actúan en el interior de la célula provocando en ella cambios adaptativos.
i) Substancias que intervienen en las reacciones en las que hay transferencias de energía.
Estas moléculas actúan captando energía en aquellos procesos químicos en los que se produce y cediéndola en los que se necesita. En general, se trata de nucleótido o derivados de nucleótidos Así, por ejemplo:
ATP (adenosina5'trifosfato): AdeninaRibosaPPP.
ADP (adenosina5'difosfato): AdeninaRibosaPP
La hidrólisis del enlace entre los dos últimos fosfatos en el ATP según la reacción:
ATP+H2O > ADP+ Pi
 genera 7 kcal/mol. El proceso inverso es capaz de almacenar las mismas 7 kcal/mol. De esta forma la energía es transportada de aquellos procesos donde se produce a aquellos en los que se necesita.
genera 7 kcal/mol. El proceso inverso es capaz de almacenar las mismas 7 kcal/mol. De esta forma la energía es transportada de aquellos procesos donde se produce a aquellos en los que se necesita. ii) Coenzimas que intervienen en las reacciones en las que hay transferencias de electrones
Estas moléculas, en su estado oxidado, captan electrones de aquellas sustancias que se oxidan, reduciéndose, y los ceden a aquellas que se reducen, oxidándose. De estas forma, los electrones son transportados de unas moléculas a otras.
NAD+ / NADH (Nicotinamín adenín dinucleótido en forma oxidada y reducida, respectivamente). Se trata de un dinucleótido formado por:
Nicotinamida-Ribosa-P-P-Ribosa-Adenina.
NADP+ /NADPH (Nicotinamín adenín dinucleótido fosfato, en forma oxidada y reducida, respectivamente). Similar NAD+ pero con un grupo fosfato más esterificando el HO del carbono 2 de la ribosa unida a la adenina.
FAD/FADH2 (Flavín adenín dinucleótido, en forma oxidada y reducida, respectivamente). Similar al NAD pero conteniendo riboflavina (otra de las vitaminas del complejo B2) en lugar de nicotinamida.
iii) Coenzimas que intervienen como transportadores de grupos acilo.
Coenzima A. Coenzima de estructura compleja y de la que forma parte el ácido pantoténico (otra de las vitaminas del complejo B2).
Los ácidos nucleicos pueden presentar otras bases nitrogenadas secundarias, lo más general es que sean formas metiladas de las bases principales.
ESTRUCTURA BIOLOGICA DEL DNA: Doble hélice, cadenas complementarias y antiparalelas.
El ADN, concepto general.Están formados por muchos nucleótidos, es decir son polinucleótidos. Todo el genoma humano está formado por 3.109 pares de nucleótidos. Según su longitud hay diversos tamaños desde 1,7 µm (virus de la poliomielitis) a 2,36 m (todo el genoma humano).
 Son Desoxirribonucleótidos de A, G, C y T unidos por enlaces fosfodiéster en el sentido 5' 3'
Son Desoxirribonucleótidos de A, G, C y T unidos por enlaces fosfodiéster en el sentido 5' 3' Su peso molecular es elevado.
Se encuentra asociado a proteínas básicas formando nucleoproteínas (en células eucariotas, son histonas o protaminas).
(En las procariotas está asociado a proteínas similares).
Se pueden distinguir 3 Niveles estructurales:
Estructura primaria: La secuencia de los nucleótidos.
Estructura secundaria: la doble hélice.
Estructura terciaria: Collar de perlas, estructura cristalina, ADN superenrollado.
También se distinguen en las células eucariotas a partir de la propia estructura 3ª varios niveles de empaquetamiento.
ESTRUCTURA PRIMARIA DEL ADN.
Es la secuencia de nucleótidos de una cadena o hebra. Es decir la estructura primaria del ADN viene determinada por el orden de colocación de los nucleótidos en la hebra o cadena de la molécula. Al existir la posibilidad de combinar cuatro nucleótidos distintas existe un elevado número de polinucleótidos lo que determina que el ADN contenga el mensaje biológico o información genética y explica la diversidad del mensaje genético de todos los seres vivos.
Al existir la posibilidad de combinar cuatro nucleótidos distintas existe un elevado número de polinucleótidos lo que determina que el ADN contenga el mensaje biológico o información genética y explica la diversidad del mensaje genético de todos los seres vivos. ESTRUCTURA SECUNDARIA
Datos preliminares:A) A finales de los 40 Erwin CHARGAFF y sus colaboradores estudiaron los componentes del DNA y emitieron los siguientes resultados:
La concentración de bases varía de una especie a otra. El porcentaje de A, G, C y T es el mismo en los individuos de la misma especie y no por esto el mensaje es el mismo.
Tejidos diferentes de la misma especie tienen la misma composición en bases.
La composición en bases del DNA de una misma especie no varía con la edad del organismo ni con su estado nutricional ni con las variaciones ambientales.
Las densidades y viscosidades corresponden a la existencia de enlaces de Hidrógeno entre los grupos NH y los grupos CO.
La concentración de Adenina es igual a la de Timina, y la de Citosina a la de Guanina. Las dos primeras establecen dos puentes de hidrógeno entre ellas, y las últimas tres puentes. La cantidad de purinas es igual a la cantidad de pirimidinas.
B) Por medio del método analítico de difracción de rayos X, FRANKLIN Y WIL KINS observaron una estructura fibrilar de 20 Å (Amstrongs) de diámetro con repeticiones cada 3,4 Å y una mayor cada 34 Å.
C) WATSON Y CRICK en 1953 postularon un modelo tridimensional para la estructura del DNA que estaba de acuerdo con todos los datos disponibles anteriores.
Así establecen el MODELO DE DOBLE HELICE:
La molécula de ADN está formada por dos cadenas antiparalelas y equidistantes de nucleótidos, enrolladas en espiral en torno a un eje imaginario, formando una hélice dextrógira.
Las bases nitrogenadas se encuentran en el interior de la hélice unidas mediante puentes de hidrógeno y siempre emparejadas AT y CG, lo que hace que las dos cadenas sean complementarias.
Las desoxirribosas y los grupos fosfato que las unen se encuentran en el exterior de la hélice, de modo que las cargas negativas de los grupos fosfato interaccionan con los cationes presentes en el nucleoplasma dando más estabilidad a la molécula.
El modelo de Watson y Crick dio una explicación coherente y satisfactoria para las propiedades fisicoquímicas del ADN y su función biológica, como estabilidad biológica y capacidad de duplicación
Las grandes moléculas de ADN se encuentran enrolladas por necesidad de reducir espacio en la célula y como mecanismo para preservar su transcripción
TIPOS DE ADN.
Según la estructura: monocatenarios una cadena, (por ej. algunos virus) o bicatenarios con dos hebras o cadenas. A su vez en ambos casos puede ser el ADN lineal (ej. el núcleo de células eucariotas y algunos virus) o circular (en mitocondrias, cloroplastos y bacterias y algunos virus).ACIDO RIBONUCLEICO (RNA o ARN).
 Polinucleotido formado por ribonucleótidos de A, G, C y U, que se unen por enlaces fosfodiéster 5' 3'.
Polinucleotido formado por ribonucleótidos de A, G, C y U, que se unen por enlaces fosfodiéster 5' 3'. Es monocatenario en general, bicatenario en algunos virus, (por ej. los reovirus). La molécula es más corta que la del DNA.
No forma cadenas dobles salvo excepciones. A veces en ciertos tramos puede poseer estructura secundaria al aparecer apareamientos de bases dentro de la misma cadena (existiendo complementariedad de bases y antiparalelismo) y estructura terciaria (si se encuentra asociado a proteínas).
TIPOS: Bicatenario (ej. reovirus), Monocatenario (ARN de transferencia o transferente, ARN mensajero, ARN ribosómico y ARN nucleolar).
Se encuentra en muchos virus, en las células procariotas y en las células eucariotas.
[1]1 u = 1 da = 1,66.1024 gr.
[2]* En el caso de la hélice de colágeno la disposición es similar pero la hélice que resulta está más distendida porque la abundancia de aminoácidos como la prolina e hidroxiprolina, que poseen un radical muy voluminoso, dificultan la formación de puentes de hidrógeno entre las espiras. La estabilidad final de ésta estructura se consigue por la asociación de tres hélices para formar una superhélice que gira hacia la izquierda. Por este motivo, tres polipéptidos ensamblados, para muchos bioquímicos esa sería una estructura típicamente cuaternaria. Esta estructura es prácticamente exclusiva del colágeno, de ahí su nombre.



No hay comentarios:
Publicar un comentario