Las técnicas de DNA recombinante se desarrollaron en un principio como
herramientas que permitirían a los científicos obtener una gran cantidad de copias de
cualquier segmento de DNA específico, de manera que éste pudiera estudiarse desde
el punto de vista bioquímico. Esto se realizó en un inicio introduciendo DNA ajeno en células de microorganismos. En condiciones apropiadas, éste se duplica y transmite a
las células hijas cuando la original se divide. Así una secuencia de DNA específica puede ser amplificada o clonada para producir millones de copias idénticas que pueden aislarse en forma pura. En la actualidad son cada vez más importantes los métodos in vitro.
La tecnología del DNA recombinante tiene varias aplicaciones, una de las que más avanza es la ingeniería genética, que implica la modificación del DNA de un
organismo para producir nuevos genes con nuevas características. Su desarrollo se debe al descubrimiento de las enzimas de restricción y de la transformación bacteriana
de los plásmidos. Las bacterias producen enzimas conocidas como de restricción, las cuales cortan las moléculas de DNA sólo en lugares específicos.
La amplificación de un fragmento de DNA puede lograrse in vitro, con el uso de polimerasas de DNA de bacterias termorresistentes e in vivo, introduciendo moléculas
de DNA recombinante (vector + inserto DNA) en bacterias u otros microorganis
mos como las levaduras.
Las enzimas de restricción son “tijeras moleculares” cuya especificidad permite
realizar cortes del DNA de manera controlada. Existen varias enzimas conocidas, un
ejemplo es Bam HI que reconoce y corta una molécula de DNA en la secuencia de
bases 5´G/GATTCC-3´, otro es EcoRI, que corta la secuencia 5´-G/AATTC-3´.
Muchas de las enzimas empleadas para estudios de DNA recombinante cortan
secuencias polindrómicas, en las cuales una cadena se lee igual que su complemento
pero en sentido opuesto, por ejemplo para 5´-AAGCTT-3´ se lee, 3´-TTCGAA-5´.
Cuando la enzima corta, quedan extremos de cadenas sencillas complementarios a los
que se denomina “pegajosos” por la posibilidad que poseen de unirse entre sí
por enlaces de hidrógeno. Además, el fragmento puede tratarse con una ligasa de DNA
para lograr una molécula recombinante estable.
En la figura se muestra el mecanismo de acción de una enzima de restricción.

Luego del aislamiento, los fragmento del DNA, deben ser incorporados a un
portador adecuado llamado vector para poder ser amplificado.
Vectores
Después de unirse a un vector o vehículo de clonación, un segmento de DNA
puede llegar a entrar en una célula huésped y replicarse (clonarse). Los vectores son,
esencialmente, moléculas de DNA transportadoras. Para servir de vector, una molécula
de DNA debe tener unas determinadas características:
1. Debe poder replicarse independientemente junto con el segmento de DNA que
transporta.
2. Debe contener varios sitios de corte para enzimas de restricción, presentes sólo una
vez en el vector. Estos sitios de restricción únicos permiten insertar segmentos de
DNA cortados con la misma enzima sin desmembrar el vector, situación que se
produciría si se utilizasen sitios de restricción presentes más de una vez en el
vector.
3. Debe tener algún marcador de selección, (normalmente genes de resistencia a
antibióticos o genes de enzimas que la célula huésped no tenga) para poder
distinguir las células huésped que transportan al vector, de las que no las contienen.
4. El vector debería poder extraerse fácilmente de la célula huésped.
Actualmente se utilizan tres tipos principales de vectores: los plásmidos, los
bacteriófagos y los cósmidos.
Los plásmidos
Un plásmido es una molécula circular separada del DNA bacteriano y mucho
más pequeña que éste pero con la capacidad de duplicarse dentro de la célula
bacteriana y de brindarles facultades para desarrollarse en condiciones específicas en
las que no podrían hacerlo si no estuvieran transformadas.
Son moléculas de DNA de doble cadena extracromosómicas de origen natural
que tienen un origen de replicación (ori+) y que se replican autónomamente en células
bacterianas. Para poder utilizarlos en ingeniería genética, se han modificado de manera
que contengan un número limitado de sitios de restricción y genes de resistenciaa antibióticos específicos.
El vector pBR322 fue uno de los primeros plásmidos diseñados que se utilizó.

Figura. Mapa de restricción del plásmido pBR322, que muestra las localizaciones de
los sitiosde las enzimas de restricción que cortan el plásmido por un solo sitio.
Estos sitios pueden utilizarse para insertar los fragmentos de DNA a clonar.
También se muestran las localizaciones de los genes de resistencia a antibióticos.
Este plásmido tienen un origen de replicación (ori), dos genes de selección
(resistencia a los antibióticos ampicilina y tetraciclina), y algunos sitios de restricción
únicos. Dentro del gen de resistencia a tetraciclina hay sitios de restricción únicos para
las enzimas BamHI, SpbI, SalI, XmaIII y NruI, y dentro del gen de resistencia a ampicilina hay sitios de restricción únicos para las enzimas RruI, PvuI, y PstI. Si se
introduce un pBR322 en una célula bacteriana sin plásmidos y sensible a antibióticos,
la célula se convertirá en resistente a la tetraciclina y a la ampicilina. Si se inserta un
fragmento de DNA en los sitios de restricción RruI, PvuI, o PstI, se inactivará el gen de
resistencia a ampicilina, pero el gen de resistencia a tetraciclina seguirá activo. Si este
plásmido recombinante se transfiere a una célula bacteriana que no contenga
plásmidos, las células que contengan el plásmido recombinante podrán identificarse, ya
que serán resistentes a tetraciclina y sensibles a ampicilina.

Figura. El plásmido pUC18 ofrece varias ventajas como vector de clonación. Debido a su
pequeño tamaño, puede aceptar fragmentos de DNA relativamente grandes; se replica hasta
un alto número de copias y tiene un gran número de sitios de restricción en el sitio de clonación
múltiple, localizado dentro del gen lacZ. Las bacterias que contienen pUC18 producen colonias
de color azul si crecen en un medio que contenga X-gal. El DNA insertado en el sitio de
clonación múltiple interrumpe el gen lacZ, resultando en colonias blancas, lo que permite la
identificación directa de las colonias que tienen insertos de DNA clonados.
Los bacteriófagos lambda y M13
Lambda es un bacteriófago muy utilizado en experimentos de DNA recombinante.Se han identificado y cartografiado todos los genes de lambda, y se cConoce toda la secuencia nucleotídica de su genoma. El tercio central de su
cromosoma es prescindible, y puede reemplazarse por DNA exógeno sin afectar la
capacidad del fago para infectar células y formar calvas. Se han desarrollado más de
100 vectores basados en el fago lambda, eliminado diversas porciones del grupo
génico central. Para clonar utilizando el vector lambda, se corta el DNA del fago con
una enzima de restricción (por ejemplo, EcoRI), lo que produce un brazo izquierdo, un
brazo derecho y una región central. Se aislan los brazos y se ligan (utilizando la DNA
ligasa) a un segmento de DNA obtenido tras cortar DNA genómico con la misma
enzima de restricción (en este ejemplo EcoRI).
Las moléculas recombinantes resultantes pueden introducirse en células
huésped bacterianas de dos maneras: Por transformación. Una vez en las células
huésped, se replican generando fagos infectivos, llevando cada uno de ellos el inserto
de DNA. Por infección , se mezcla el DNA de lambda que contiene el inserto con los
componentes proteicos del fago (cabezas y colas); de esta mezcla se forman partículas
fágicas infectivas (empaquetamiento “in vitro”). Los fagos pueden amplificarse
haciéndose crecer en placas sembradas con bacterias, donde se formarán calvas, o
bien infectando células en un medio líquido y recogiendo las células lisadas.

Figura. Pasos en la
clonación utilizando el fago
lambda como vector. Se
extrae el DNA de una
preparación de fago lambda
y se elimina el grupo central
de genes por tratamiento
con una enzima de
restricción. El DNA a clonar
se corta con la misma
enzima y se liga entre los
brazos del cromosoma de
lambda. Luego se
empaqueta el cromosoma
recombinante dentro de las
proteínas del fago para
formar un virus
recombinante. Este virus
puede infectar células
bacterianas y replicar su
cromosoma, incluido el
inserto de DNA.
Los cósmidos y los vectores transbordadores
Los cósmidos son vectores híbridos construidos utilizando partes del cromosoma
del fago lambda y de DNA plasmídico. Los cósmidos contienen la secuencia cos del
fago lambda, necesaria para el empaquetamiento del DNA del fago dentro de su
cubierta proteica, y secuencias plasmídicas de replicación (ori) y de genes de
resistencia a antibióticos, que permiten identificar las células huésped que los contienen. El DNA de los cósmidos que contienen insertos de DNA se empaqueta en la
cápside proteica de lambda para formar partículas fágicas infectivas.
Una vez que el cósmido entra en la célula huésped se replica como un
plásmido. Puesto que la mayoría del genoma lambda se ha delecionado, los cósmidos
pueden transportar insertos de DNA mucho más grandes que los que lambda puede
llevar. Los cósmidos pueden transportar casi 50kb de DNA insertado; los vectores
fágicos pueden acomodar insertos de DNA de unas 15 kb, y los plásmidos
generalmente están limitados a insertos de 5- 10 kb.
Existen otros vectores híbridos, construidos con orígenes de replicación
provenientes de distintas fuentes (por ejemplo, plásmidos y virus animales como
SV40), que pueden replicarse en más de un tipo de célula huésped. Generalmente,
estos vectores transbordadores contienen marcadores genéticos que permiten su
selección en los dos sistemas huésped, y pueden utilizarse para transportar insertos de
DNA entre E. coli y otras células huésped como levadura y viceversa.
A menudo, estos vectores se emplean para investigar la expresión génica.
Figura. El cósmido pJB8 contiene un origen de
replicación bacteriano (ori), un solo sitio cos
(cos), un gen de resistencia a ampicilina (amp)
para seleccionar las colonias que han
incorporado el cósmido, y una región que
contiene cuatro sitios de restricción para la
clonación (BamHI, EcoRI, Clal y Hind III). Las
cubiertas víricas que contienen un cósmido
pueden utilizarse para infectar células huésped
adecuadas, y el vector que transporta el inserto
de DNA se transferirá a la célula huésped por
 infección. Una vez dentro, la secuencia ori
infección. Una vez dentro, la secuencia ori permite que el cósmido se replique como un
plásmido bacteriano.
Para cartografiar y analizar genomas eucarióticos complejos, se desarrolló un
vector multiuso llamado cromosoma artificial bacteriano (BAC) basado en el factor F de
bacterias. Éste es un plásmido que se replica independientemente y está implicado en
la transferencia de información genética en la conjugación bacteriana. Como los
factores F pueden transportar fragmentos del cromosoma bacteriano de hasta 1 Mb, se
diseñaron para que funcionen como vectores de DNA eucariótico. Los vectores BAC
tienen los genes de replicación y de número de copia del factor F, e incorporan un
marcador de resistencia a un antibiótico y sitios de restricción para insertar el DNA
exógeno a clonar. Además, el sitio de clonación está flanqueado por regiones
promotoras que pueden utilizarse para generar moléculas de RNA y expresar así el gen
clonado, o para utilizarlas como sonda para paseo cromosómico, y para secuenciar el
DNA del inserto clonado.


Figura. Resumen de los pasos seguidos en la clonación de un vector plasmídico. Los vectores plasmídicos se aíslan y
se cortan con una enzima de restricción. El DNA a clonar se corta con la misma enzima de restricción, produciendo
una colección de fragmentos. Estos fragmentos se reparten entre los vectores y se transfieren a huéspedes
bacterianos para su replicación. Las células bacterianas que contienen plásmidos pueden identificarse por crecimiento en un medio selectivo, y pueden aislarse. El DNA clonado puede recuperarse del huésped bacteriano para nuevos análisis.
Para replicar el DNA clonado se pueden utilizar distintos tipos de células
huésped. Uno de los huéspedes más utilizados es la cepa de laboratorio K12 de E. coli.
Ésta y otras cepas de E. coli se utilizan como huéspedes ya que están bien
caracterizadas genéticamente y pueden aceptar un amplio espectro de vectores,
incluyendo los plásmidos, los fagos y los cósmidos.
Para crear moléculas de DNA recombinante se precisan varios pasos. Si se utiliza
un plásmido como vector, el procedimiento es el siguiente:
1. El DNA que se va a clonar se aísla y se trata con una enzima de restricción para
crear fragmentos que acaben en secuencias específicas.
2. Estos fragmentos se ligan a moléculas de plásmido que han sido cortadas con la
misma enzima de restricción, obteniéndose un vector recombinante.
3. El vector recombinante se transfiere a células huésped bacterianas,
generalmente por transformación, un proceso en el que las moléculas de DNA
atraviesan la membrana de la célula huésped transfiriéndose a su interior.
4. La célula huésped se hace crecer en una placa de cultivo, donde formará
colonias. Puesto que las células de cada una de las colonias provienen de una
sola célula inicial, todas las células de la colonia, y los plásmidos que contienen,
son genéticamente idénticas, o clones. Se rastrean las colonias para identificar
las que han incorporado el plásmido recombinante.
Se utilizan varios métodos para seleccionar las colonias que contienen plásmidos con el inserto de DNA. Este proceso se denomina rastreo (o cribado). Para vectores como pBR322, el rastreo es un proceso que consiste en dos etapas. Por ejemplo, si el DNA que se desea clonar se inserta dentro del gen de resistencia a tetraciclina, este gen se inactivará. Después de transformar células huéspedes con el plásmido recombinante, éstas se hacen crecer en placas de cultivo que contienen el antibiótico ampicilina. Todas las células que hayan incorporado un plásmido (con o sin inserto) crecerán y formarán colonias, mientras que las células que no lo hayan incorporado morirán ya que son sensibles a la ampicilina.
En el segundo paso, se identifican las colonias que contiene plásmidos con el inserto de DNA. En este paso, se transfieren las colonias de la placa que contiene ampicilina a una placa que contiene tetraciclina, debido a que el inserto ha inactivado el gen de resistencia a tetraciclina. Entonces, el patrón de colonias de la placa con tetraciclina se compara con el de la placa con ampicilina, y se identifica las colonias de la placa con ampicilina que no han crecido en la placa con tetraciclina. Las células de estas colonias contienen vectores con el inserto de DNA, y se transfieren a un medio de crecimiento para nuevos análisis.

Figura. Selección de colonias que contienen un vector plasmídico que tiene dos genes de
resistencia a antibióticos, uno para tetraciclina y otro para ampicilina. En este experimento,
la presencia del inserto de DNA en el plásmido inactivará el gen de resistencia de
tetraciclina.
Otros vectores, como pUC18, tienen construcciones que producen colonias
azules cuando están en células bacterianas sembradas en un medio que contiene una
sustancia denominada X-gal. Los sitios de restricción del sitio de clonación múltiple de
pUC18 están dentro del gen lac, el gen responsable de la capacidad de formar colonias
azules, y la inserción de DNA en el sitio de clonación múltiple interrumpe esta
capacidad. Como se ha expuesto anteriormente, los plásmidos que contienen los
segmentos de DNA insertados producen colonias blancas, mientras que los que no
tienen insertos producen colonias azules.
De igual modo, los fagos que contengan DNA exógeno también pueden
utilizarse para infectar células huésped de E. coli, y cuando se siembran en un medio
sólido, cada una de las calvas resultantes representa los descendientes clonados de
un solo fago inicial. Los cósmidos infectan a las células bacterianas como los fagos,
pero luego se replican como los plásmidos dentro de la célula huésped. Las células que
contiene cósmidos con DNA clonado pueden identificarse y recuperarse de la misma
manera que los plásmidos.
Clonación en huéspedes eucarióticos
Hemos descripto la utilización de E. coli como huésped para la clonación.
También pueden utilizarse otras especies de bacterias como huéspedes, como B.
Subtilis y Streptomyces. Estos sistemas huésped bacterianos y sus vectores son
parecidos a los descriptos para E.coli. Sin embargo, para estudiar la expresión y
regulación de los genes eucarióticos, a menudo es conveniente e incluso necesario
utilizar huéspedes eucarióticos. En esta sección describiremos sistemas de clonación
que utilizan células eucarióticas como huéspedes.
Vectores de levadura
Aunque la levadura es un organismo eucariótico, puede manipularse y crecer de
manera parecida a las células bacterianas. Además, la genética de las levaduras se ha
investigado exhaustivamente, lo que ha proporcionado un gran catálogo de mutaciones
y unos mapas genéticos altamente detallados de sus cromosomas. En levadura hay un
plásmido de origen natural, denominado plásmido 2 micras (o plásmido 2 µ), que se
ha utilizado para construir varios vectores de clonación para levadura. Combinando
secuencias de plásmidos bacterianos con plásmidos 2 micras, se pueden producir
vectores con muchas propiedades útiles.
Construcción de bibliotecas de DNA
Puesto que cada segmento de DNA clonado es relativamente pequeño, deben
construirse muchos clones diferentes para incluir todas las pequeñas porciones del
genoma de un organismo. El conjunto clonado de todas las secuencias genómicas de
un solo individuo se denomina biblioteca. Las bibliotecas clonadas pueden provenir del
genoma completo de un individuo, del DNA de un solo cromosoma, o del conjunto de
genes transcripcionalmente activos en un único tipo celular.
Las bibliotecas genómicas (o genotecas) suelen construirse utilizando vectores
fágicos, que pueden contener grandes fragmentos cromosómicos. Para preparar una
biblioteca en el fago lambda, se corta el DNA de lambda con una enzima de restricción
para eliminar el grupo génico central. El DNA genómico que se desea clonar se corta
con la misma enzima, y se purifican los fragmentos cortados de tamaño óptimo para el
empaquetamiento (de 15 a 17kb) mediante electroforesis en gel o por centrifugación.
Estos fragmentos de DNA se ligan con los brazos del cromosoma de lambda para
formar la biblioteca.
En una biblioteca genómica están representados todos los genes de un
organismo. La biblioteca es un medio para recuperar cualquier gen del genoma del
organismo, pudiéndose estudiar con detalle junto con sus secuencias reguladoras
adyacentes. Teóricamente, una biblioteca genómica contiene al menos una copia de
todas las secuencias representadas en el genoma. Sin embargo, cada molécula de
vector puede contener sólo relativamente pocas kilobases de DNA insertado, por lo que
una de las primeras tareas al preparar una biblioteca genómica es seleccionar el vector
más adecuado para contener el genoma completo en el menor número posible de
clones. El número de clones necesarios para contener todas las secuencias de un
genoma depende del tamaño medio de los insertos clonados y del tamaño del genoma
a clonar. Este número puede calcularse con la siguiente fórmula:
N= ln (1-P)
ln (1- ƒ)
Donde N es el número de clones necesarios, P es la probabilidad de recuperar
una secuencia determinada, y ƒ representa la fracción del genoma presente en cada
clon.
Si deseamos preparar una biblioteca del genoma humano utilizando como
vector el fago lambda. El genoma humano tiene 3,0 x 106 kb; si el tamaño medio de los
insertos clonados en el vector es 17 kb, y queremos tener una probabilidad del 99 %
(P=0,99) de que cualquier gen humano esté representado al menos en una copia,
precisaremos una biblioteca de unos 8,1x 105 fagos (donde f= 1,7 x104/3,0 x 109). Si
hubiésemos seleccionado a pBR322 como vector, con una tamaño medio de insertos
de 5 kb, la biblioteca necesitaría contener varios millones de clones.
Bibliotecas de cDNA
Se puede construir una biblioteca que represente los genes que se están
transcribiendo en una célula eucariótica en un momento dado, utilizando el mRNA
aislado de esa célula. Casi todas las moléculas de mRNA eucariótico tiene una cola de
poli-A en su extremo 3’. Primero, se hibrida la población de moléculas de mRNA que
tienen colas de poli-A 3’ con oligo-dT (DNA corto de cadena sencilla formado sólo por
dexositimidina). La secuencia de oligo-dT híbrida con la cola de poli –A, y sirve de
cebador para la síntesis de una cadena complementaria de DNA utilizando la enzima
retrotranscriptasa (transcriptasa inversa). Esta enzima es una DNA polimerasa
dependiente de RNA que copia un molde de RNA de cadena sencilla en un DNA de
cadena sencilla. El resultado es un dúplex RNA-DNA de doble cadena. La cadena de
RNA se elimina y la cadena sencilla de DNA se utiliza como molde para sintetizar la
cadena complementaria de DNA, utilizando la DNA polimerasa I. El extremo 3’ de la
cadena sencilla de DNA se dobla sobre sí mismo formando una horquilla (un lazo), por
lo que puede servir de cebador para sintetizar la segunda cadena. El resultado es un
DNA dúplex con las cadenas unidas por un extremo. La horquilla puede abrirse,
Obteniéndose una molécula de DNA de doble cadena (denominada DNA
complementario o cDNA), cuya secuencia nucleotídica deriva de una molécula de
RNA.
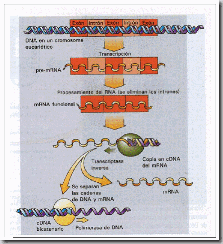
Si se añade un trozo corto de DNA con sitios de restricción en cada uno de sus
extremos, el cDNA puede clonarse. Este sitio de clonación puede cortarse con la
enzima de restricción adecuada, produciendo extremos pegajosos, lo que permite que
el cDNA se inserte en el sitio de restricción de un vector plasmídico o fágico.
Una biblioteca de cDNA es diferente de una biblioteca genómica ya que
representa sólo un subconjunto de todos los genes del genoma. Otra diferencia es que
las bibliotecas de cDNA no contienen las secuencias promotoras adyacentes al gen, ni
tampoco contienen las secuencias intercaladas o intrones, ya que éstos han sido
eliminados del pre-mRNA durante la reacción de corte y empalme y no se encuentran
en el mRNA maduro.
Las bibliotecas de cDNA utilizan mRNA como punto de partida, de manera que
sólo representan a las secuencias que se están expresando en un tipo celular, en un
tejido, o en un estadio concreto del desarrollo embrionario. La decisión de construir una
biblioteca genómica o de cDNA depende del problema planteado. Si se está interesado
en un gen particular, podría ser más fácil preparar una biblioteca de cDNA del tejido en
el que se expresa dicho gen. Por ejemplo, los glóbulos rojos producen grandes
cantidades de hemoglobina, y la mayoría del mRNA de estas células es mRNA de la
β-globina. Una biblioteca de cDNA preparada utilizando mRNA aislado de glóbulos
rojos permite aislar con facilidad un gen de la globina. Si se interesaran las secuencias
reguladoras adyacentes al gen de la globina, se necesitaría construir una biblioteca
genómica, ya que estas secuencias reguladoras no se encuentran en el mRNA de la
globina, y por lo tanto no estarían representadas en la biblioteca de cDNA.
Identificación de secuencias clonadas específicas
Una biblioteca genómica puede contener varios cientos de miles de clones. El
problema ahora es identificar y seleccionar sólo el clon o clones que contienen el gen
que nos interesa, y determinar si un clon contiene todo el gen o sólo una parte de él.
Hay varias maneras de hacerlo, y la elección depende de las circunstancias y de la
información disponible. Los métodos que se describen a continuación utilizan diversos
enfoques para encontrar una secuencia específica de DNA en una biblioteca.
Sondas para rastrear clones específicos
Muchos de los protocolos utilizan una sonda para rastrear la biblioteca e
identificar el clon que contiene el gen de interés. A menudo, las sondas son
polinucleótidos radioactivos que contienen una secuencia de bases complementaria a
todo o parte del gen de interés. Otros métodos utilizan sondas que dependen de
reacciones químicas o colorimétricas para indicar la localización de un clon específico.
Las sondas pueden provenir de distintas fuentes; genes relacionados aislados de otras
especies pueden servir de sonda si la secuencia se ha conservado suficientemente.
Por ejemplo, se aislaron copias extracromosómicas de genes ribosómicos de la rana
Xenopus laevis por centrifugación, se cortaron con enzimas de restricción, y se
clonaron en vectores plasmídicos. Como las secuencias de los genes ribosómicos se
han conservado enormemente durante la evolución de los eucariotas, estos genes
clonados de Xenopus se marcaron con radioisótopos y se utilizaron como sonda para
aislar los genes ribosómicos humanos de una biblioteca genómica.
Si el gen que se quiere seleccionar de la biblioteca es transcripcionalmente
activo en determinados tipos celulares, se puede utilizar una sonda de cDNA para
encontrarlo. Esta técnica es especialmente útil cuando puede obtenerse el mRNA
purificado o enriquecido. Se sabe que el mRNA de la $-globina es el RNA mensajero
predominante en determinados estadios del desarrollo de los glóbulos rojos. Para hacer
una sonda, se aísla el mRNA de estas células, se purifica, y se copia con la
retrotranscriptasa en una molécula de cDNA. Este cDNA puede utilizarse como sonda
para recuperar el gen de la $-globina de una biblioteca genómica, incluyendo los
intrones y las regiones de control adyacentes.
Métodos de análisis de las secuencias clonadas
La identificación y recuperación de secuencias de DNA clonadas especificas es
una herramienta poderosa para analizar la estructura y la función de los genes. Las
técnicas que se describen a continuación se utilizan para responder a preguntas
experimentales de la organización y de la expresión de las secuencias clonadas.
Cartografía de restricción
Un mapa de restricción es la recopilación del número, del orden y de la
distancia entre los sitios de corte de enzimas de restricción en un segmento clonado de
DNA. Las unidades de mapa se expresan en pares de bases (pb) o, para largas
distancias, en pares de kilobases (kb). Los mapas de restricción proporcionan
información que puede utilizarse para subclonar fragmentos de un gen, o bien para
comparar la organización de un gen y de su cDNA con el fin de identificar los exones y
los intrones en la copia genómica del gen.
Los fragmentos generados tras cortar el DNA con enzimas de restricción pueden
separarse mediante electroforesis en gel, método que separa los fragmentos por su
tamaño, y en el que los fragmentos más pequeños se mueven más rápidamente. Los
fragmentos aparecen como una serie de bandas que pueden visualizarse tiñendo el
DNA con bromuro de etidio e iluminándolo con luz ultravioleta (siguiente figura).El tamaño de los fragmentos individuales puede determinarse corriendo un conjunto de
fragmentos marcadores de tamaño conocido en otro carril del mismo gel.

Figura. Gel de agarosa que contiene fragmentos separados de DNA, teñidos con un
Colorante (bromuro de etidio) y visualizados mediante iluminación ultravioleta.
La siguiente figura muestra los pasos que deben seguirse para construir el
mapa de restricción de un segmento de DNA clonado que contiene sitios de corte para
dos enzimas de restricción. Para construir el mapa, empecemos con una segmento de
DNA clonado de 7 kb de longitud. Tres muestras del DNA clonado se digieren con
enzimas de restricción: una conHindIII; otra con SalI; y la última con las dos
enzimas nombradas. Los fragmentos generados por la digestión con las enzimas de
restricción se separan por electroforesis. El tamaño de estos fragmentos se estima por
comparación con un conjunto de patrones de tamaño separados electroforéticamente
en carriles adyacentes del mismo gel. Para construir el mapa, se analizan los
fragmentos generados con las enzimas de restricción.
1.Cuando el DNA se corta con HindIII, se producen dos fragmentos, uno de 0,8 kb
y otro de 6,2 kb, indicando que sólo hay un sitio de restricción para esta enzima (y que
está localizado a 0,8 kb de uno de los extremos).
2.Cuando el DNA se corta con SalI, se producen dos fragmentos, uno de 1,2 kb y
otro de 5,8 kb, lo que significa que hay un único sitio de restricción localizado a 1,2 kb
de uno de los extremos.
En conjunto, estos resultados muestran que hay un sitio de restricción para cada
enzima, pero se desconoce la relación existente entre estos dos sitios. Con esta
información, hay dos mapas posibles. En un modelo, el sitio HindIII está a 0,8 kb de
uno de los extremos (modelo I), y el sitio SalI está a 1,2 kb del mismo extremo. En el
modelo alternativo (modelo 2), el sitio HindIII está localizado a 0,8 kb de un extremo, y
el sitio SalI está localizado a 1,2 kb del otro extremo.
El modelo correcto puede determinarse si se consideran los resultados de la
digestión de ambas enzimas, HindIII y SalI. El modelo 1 predice que la digestión con
ambas enzimas generará tres fragmentos de 0,4, 0,8 y 6,2 kb; ambas enzimas
generarán tres fragmentos de 0,8, 1,2 y 5 kb. El patrón real de fragmentos observado
después de la digestión con ambas enzimas indica que el modelo correcto es el modelo
1 de la Figura.
En la mayoría de los casos, la cartografía de restricción es más compleja e
implica un mayor número de enzimas y un mayor número de sitios para cada enzima.
Los mapas de restricción proporcionan una manera importante de caracterizar un
segmento de DNA, y pueden construirse sin tener ninguna información de la capacidad
codificadora ni de la función del DNA cartografiado. Junto con otras técnicas, el
cartografiado de restricción puede utilizarse para definir los extremos de un gen, y
proporciona una manera de diseccionar la organización molecular de un gen y de sus
regiones flanqueantes. El cartografiado también puede servir de punto de partida para
analizar un gen intacto de segmentos clonados de DNA, y proporciona una
manera de localizar sitios de mutación en los genes.
Los mapas de restricción también pueden utilizarse para refinar los mapas
génicos. En la mayoría de los casos, la exactitud de los mapas construidos por análisis
genéticos se basa tanto en la frecuencia de recombinación entre marcadores genéticos
como en el número de marcadores genéticos utilizados en la construcción del mapa. Si
hay una gran distancia entre los marcadores y/o variación en la frecuencia de
recombinación, el mapa genético puede no corresponder al mapa físico de esa región
cromosómica. Por ejemplo, el genoma humano es grande (3,2 x 109 pb), y el número
de genes cartografiados es pequeño (unos pocos millares), lo que significa que cada
unidad del mapa está compuesta por millones de pares de bases de DNA. El resultado
es una correlación baja entre los mapas genético y físico de los cromosomas. Los sitios
de corte de las enzimas de restricción pueden utilizarse como marcadores genéticos,
reduciendo así la distancia entre los distintos sitos del mapa, incrementando la fidelidad
de los mapas, y proporcionando puntos de referencia para la correlación de los mapas
genético y físico.
Los sitos de restricción han desempeñado una función importante en la
cartografía de genes en cromosomas humanos específicos y en regiones definidas de
cromosomas concretos. Además, si un sitio de restricción está cerca de un gen
mutante, puede utilizarse como marcador de diagnóstico. Estos sitios son conocidos
como polimorfismos de longitud de fragmentos de restricción o RFLP. Su utilización ha
demostrado ser especialmente útil, ya que los genes mutantes que provocan muchas
enfermedades genéticas humanas están muy poco caracterizados a nivel molecular, y
los sitios de restricción cercanos se han utilizado con éxito en la detección de los
individuos afectados y de los heterocigotas con riesgo de tener hijos afectados.



Transferencia de Southern y Northern
Los insertos de DNA clonados en vectores pueden utilizarse en experimentos
de hibridación para caracterizar la identidad de genes específicos, para localizar
regiones codificantes o regiones reguladoras flanqueantes en secuencias clonadas y
para investigar la organización molecular de las secuencias genómicas.
Edward Southern desarrolló la utilización de segmentos de DNA clonado,
separados por electroforesis, transferidos a filtros, y rastreado con sondas.
Conocido como transferencia de Southern (Southern blot),este procedimiento tiene muchas aplicaciones. En la transferencia de Southern, el DNA
clonado se corta en fragmentos con una o más enzimas de restricción, y estos
fragmentos se separan por electroforesis en gel (Figura 20). El DNA se desnaturaliza
dentro del gel en fragmentos de cadena sencilla, y éstos se transfieren a un filtro de un
material, normalmente nitrocelulosa o un derivado de nylon, que une el DNA. La
transferencia se hace colocando la hoja de la membrana encima del gel, y provocando
que el tampón pase por el gel y por la hoja de nitrocelulosa o de nailon por capilaridad.
El tampón pasa por el gel y por la membrana, arrastrando al DNA fuera del gel e
inmovilizándolo en la membrana.
En la práctica, esto se hace poniendo el gel con el DNA desnaturalizado sobre
una gruesa esponja que actúa de mecha. La esponja está parcialmente sumergida en
una cubeta con tampón. Se pone una membrana encima del gel, y se cubre con hojas
de papel secante o absorbente y un peso. La acción capilar arrastra el tampón de la
cubeta a través de la esponja, del gel, de la membrana, y del montón de papel secante.
Al pasar el tampón por el gel, los fragmentos de DNA se transfieren a la membrana, a
la que se unen. Después de la transferencia, el DNA de cadena sencilla se fija a la
membrana calentándola a 80 ºC o exponiéndola a la luz ultravioleta para que se hagan
uniones entre los fragmentos y la membrana.
Entonces, los fragmentos de DNA del filtro se hibridan con una sonda. Sólo
formarán híbridos los fragmentos de DNA de cadena sencilla presentes en la
membrana que sean complementarios a la secuencia nucleotídica de la sonda. Se lava
la sonda no unida, y se visualizan los fragmentos hibridados. Si se utiliza una sonda
radioactiva, la posición de la sonda se determina por autorradiografía, utilizando
película fotográfica.
Además de para caracterizar DNA clonado, la transferencia de Southern se
utiliza para muchos otros fines, como la cartografía de sitios de restricción en un gen o
cerca de él, la identificación de fragmentos de DNA que contienen un gen determinado
de entre una mezcla de muchos fragmentos, y la identificación de genes relacionados
en diferentes especies. La transferencia de Southern también se utiliza para detectar
reorganizaciones y duplicaciones en genes asociados a enfermedades genéticas
humanas y cánceres.

Figura. Transferencia de Southern.
Existe una técnica de transferencia relacionada que puede utilizarse para
determinar si un gen clonado es transcripcionalmente activo en un tipo celular o en un
tejido dado. Esta técnica detecta la presencia de RNA que sea complementario al segmento de DNA clonado. Esto se lleva a cabo extrayendo RNA de
uno o varios tipos celulares o tejidos. Se fracciona el RNA por electroforesis en gel, y el
patrón de bandas se transfiere a una membrana que une el RNA como en la
transferencia de Southern. El filtro se hibrida con una sonda de DNA de cadena
sencilla, proveniente de DNA genómico clonado o de cDNA. Si hay RNA
complementario a la sonda de DNA, éste se detectará por autorradiografía como una
banda en la película fotográfica. Como el protocolo original que utiliza DNA unido a un
filtro se conoce como transferencia de Southern, el protocolo que utiliza RNA unido al
filtro se denominó transferencia Northern.
La transferencia Northern proporciona información de la presencia de un
transcripto de RNA complementario de un gen clonado en una célula o en un tejido
determinado, y se utiliza para examinar patrones de expresión génica en tejidos
embrionarios y adultos. La transferencia Northern también puede utilizarse para
detectar cortes y empalmes alternativos del mRNA, y para detectar múltiples tipos de
transcriptos provenientes de un solo gen. La transferencia Northern también
proporciona otras informaciones de los mRNA transcriptos. Si se corre un RNA
marcador en un carril adyacente, se puede calcular el tamaño del mRNA de un gen de
interés. Además, la cantidad de RNA transcripto presente en una célula o en un tejido
está relacionado con la densidad de la banda de RNA del film de autorradiografía. Se
puede cuantificar la cantidad de RNA midiendo la densidad de la banda, lo que
proporciona una medida relativa de la actividad transcripcional. De esta manera,la
transferencia Northern puede utilizarse para caracterizar y cuantificar la actividad
transcripcional de un gen determinado en distintas células, tejidos, u organismos.
Secuenciación de DNA
En cierto sentido, la caracterización definitiva de un segmento de DNA clonado
es la determinación de su secuencia de nucleótidos. La capacidad de secuenciar DNA
clonado ha permitido grandes avances en el conocimiento de la estructura génica y de
los mecanismos de regulación. Aunque desde la década de los 40 hay técnicas que
permiten determinar la composición de bases del DNA, fue en la década de los 60
cuando se desarrollaron los métodos para determinar la secuencia de los nucleótidos.
En 1965, Robert Holley determinó la secuencia de una molécula de tRNA que contenía
74 nucleótidos. Se necesitó un año de esfuerzo para realizar este trabajo. En la
actualmente, en un laboratorio de biología molecular, es posible secuenciar más de mil
bases en una semana. En un futuro cercano, con la automatización de este proceso, se
podrán secuenciar miles de bases en un solo día.
Un método de secuenciación de DNA diseñado por Alan Maxam y Walter
Gilbert utiliza productos químicos para cortar el DNA. Este método se utilizó para
determinar la secuencia de bases de los 4.362 nucleótidos del plásmido pBR322. El
segundo método, que es el que generalmente se utiliza, lo desarrollaron Frederick
Sanger y sus colaboradores. El método de Sanger se basa en la elongación 5’ – 3’ de
las moléculas de DNA por la DNA polimerasa. Ambas estrategias generan un conjunto
de moléculas de DNA de cadena sencilla de diferentes longitudes. Para determinar la
secuencia de los nucleótidos en un segmento de DNA, ambos métodos utilizan una
serie de cuatro reacciones, realizadas en tubos separados. Estas secuencias, cuya
diferencia en tamaño es de un solo nucleótido, se separan por electroforesis en gel en
cuatro carriles adyacentes. El resultado es una serie de bandas que forman un patrón
parecido a una escalera. La secuencia puede leerse directamente del patrón de bandas
de los cuatro carriles. Los secuenciadores automáticos de DNA utilizan colorantes
fluorescentes en vez de sondas radioactivas. Se utilizan cuatro colorantes, produciendo
un patrón de picos de colores que, al leerlos, proporcionan la secuencia de DNA.
La secuenciación de DNA proporciona información de la organización de los
genes y de los sucesos mutacionales que alteran a los genes y a los productos
génicos, confirmando la conclusión de que los genes y las proteínas son moléculas
colineares. La secuenciación también se ha utilizado para examinar la organización de
las regiones reguladoras que flanquean los genes procarióticos y eucarióticos, y para
deducir la secuencia de aminoácidos de las proteínas. El gen de la fibrosis quística
(CF), una enfermedad genética humana autosómica recesiva, se identificó clonando y
secuenciando el DNA de una región del brazo largo del cromosoma 7. Como no se
conocía el producto proteico de este gen, se utilizó la secuencia de DNA para identificar
una región codificadora. Se utilizó la secuencia de DNA de esta región para generar
una probable secuencia de 1.480 aminoácidos. Esta secuencia se utilizó para buscar
secuencias aminoacídicas de proteínas conocidas en las bases de datos, lo que
permitió inferir que la proteína CF tiene características similares a las proteínas de
membrana que desempeñan una función en el transporte de iones. Nuevos
experimentos confirmaron que el producto del locus de la fibrosis quística es una proteína de membrana que regula el transporte de iones cloro por la membrana
plasmática. En la mayoría de casos de CF, el gen mutante tiene una secuencia de DNA
alterada que causa la producción de una proteína defectuosa.
Además de identificar los defectos del DNA que causan los fenotipos mutantes,
la secuenciación de DNA también se utiliza para examinar la organización de un gen (el
número de intrones y de exones, y sus límites), para proporcionar información de la
naturaleza y de la función de las proteínas codificadas por los genes, como el tamaño,
el número y tipo de dominios (región transmembrana, de unión al DNA) y de la relación
con proteínas similares y con proteínas de otros organismos.

Figura. La secuenciación del DNA se ha automatizado con la utilización de colorantes
fluorescentes, uno para cada base; las bases se leen en orden de izquierda a derecha.
Reacción en Cadena de la Polimerasa ( PCR)
Las técnicas de DNA recombinante se desarrollaron a principios de la década de
los 70, y en los años posteriores revolucionaron la manera en que los genetistas y los
biólogos moleculares dirigían sus investigaciones. En 1986, se desarrolló una nueva
técnica denominada reacción en cadena de la polimerasa (PCR), que ha ampliado
enormemente el poder de la investigación del DNA recombinante. Incluso ha reemplazado algunos de los métodos anteriores. El análisis de PCR ha encontrado
aplicaciones en una amplio abanico de disciplinas, entre las que se encuentran la
biología molecular, la genética humana, la evolución e incluso la medicina forense.
Uno de los prerrequisitospara muchas técnicas de DNA recombinante es la
disponibilidad de grandes cantidades de un segmento específico de DNA. Estos se
obtenían a menudo después de un trabajo intensivo y tedioso de clonación y
reclonación. La PCR permite la amplificación directa de segmentos de DNA específicos
sin clonación, y puede utilizarse en fragmentos de DNA que estén presentes,
inicialmente, en cantidades infinitesimalmente pequeñas. El método de PCR se basa
en la amplificación de un segmento de DNA utilizando DNA polimerasa y cebadores,
oligonucleótidos que hibridan con la cadena complementaria a la secuencia a
amplificar. Hay tres pasos fundamentales en la reacción de PCR, y la cantidad de DNA
amplificado producido sólo está limitado, en teoría, por el número de veces que se
repiten estos pasos.
1.El DNA que se requiere amplificar se desnaturaliza en cadenas sencillas. Este
DNA no necesita estar ni purificado ni clonado, y puede provenir de distintas fuentes,
incluyendo DNA genómico, muestras forenses como sangre seca o semen, muestras
almacenadas en registros médicos, pelos, restos momificados, y fósiles. El DNA de
doble cadena se desnaturaliza por calor (a unos 90º C) hasta que se disocia en
cadenas sencillas, normalmente unos 5 minutos.
2.Los cebadores hibridan al DNA de cadena sencilla. Estos cebadores son
oligonucleótidos sintéticos que hibridan con las secuencias flanqueantes del segmento
a amplificar. Generalmente se utilizan dos cebadores diferentes. Cada uno de ellos
tiene la secuencia complementaria a una de las dos cadenas del DNA. Los cebadores
se alinean con sus extremos 3’ encarados ya que hibridan a cadenas opuestas, como
se observa en la figura 22. La utilización de cebadores sintéticos significa que se debe
tener alguna información de la secuencia de DNA a amplificar.
polimerasa Taq. La polimerasa extiende los cebadores en dirección 5’ – 3’, utilizando
como molde al DNA cadena sencilla unido al cebador. El producto es una molécula de
DNA de doble cadena con los cebadores incorporados en el producto final.
Cada grupo de tres pasos se denomina ciclo. Generalmente, cada paso
del ciclo se realiza a una temperatura diferente. El ciclo puede repetirse llevando a
cabo otra vez todos los pasos. Empezando con una molécula de DNA, el primer ciclo
produce dos moléculas de DNA, dos ciclos producen cuatro, tres ciclos producen ocho,
etc. Veinticinco ciclos amplifican varios millones de veces el DNA en cuestión. El
proceso es automático y se utiliza una máquina denominada termociclador, que puede
programarse para realizar un número predeterminado de ciclos, produciendo grandes
cantidades de segmentos de DNA amplificado en unas pocas horas.
La PCR es ampliamente utilizada en laboratorios de investigación y tiene
muchas aplicaciones en campos entre los que se incluyen las enfermedades
infecciosas, la arqueología, el control de alimentos, la genética humana, la terapia del
cáncer y la evolución molecular, entre otros. En aplicaciones clínicas, la PCR se utiliza
para identificar los agentes infecciosos como el bacilo de la tuberculosis y otras
bacterias, el HIV y otros virus. La PCR tiene la ventaja de ser rápida y menos laboriosa
que las técnicas de clonación convencionales, y ha reemplazado a la utilización de
sondas clonadas en campos como el diagnóstico prenatal. Aunque el desarrollo de la
técnica de PCR representa un adelanto importante, también tiene sus limitaciones.
Puesto que la PCR amplifica secuencias de DNA, incluso la más pequeña
contaminación del material inicial con DNA de otras fuentes puede provocar
dificultades. Células desprendidas de la piel de uno de los empleados del laboratorio
mientras se realizaba la PCR pueden contaminar las muestras recogidas del escenario
del crimen, dificultando la obtención de datos fiables. La PCR debe realizarse siempre
con controles adecuados.
ESTRATEGIAS BÁSICAS PARA EL CLONADO MOLECULAR
El clonado de ADN basado en células se usa para amplificar ADN con el objeto de
poder caracterizarlo físicamente y llevar a cabo estudios funcionales de los genes, de
grupos de genes o de otras secuencias de ADN de interés.
 |
Fig. Esquema de clonado molecular en plásmido.
Ejercicio 1
La figura de arriba sintetiza los distintos pasos a seguir en un experimento de clonado
básico. Analiza el esquema y describe cada uno de ellos.
HERRAMIENTAS BÁSICAS PARA EL CLONADO
1. ENDONUCLEASAS DE RESTRICCIÓN.
Las endonucleasas de restricción reciben el nombre según la bacteria a partir de
la cual se han aislado. A continuación, a modo de ejemplo, se muestra una tabla con
los sitios de reconocimiento y corte de varias enzimas de restricción tipo II.

Ejercicio 2
a)¿ Qué son las endonucleasas de restricción?
b) ¿Qué características poseen los sitios de reconocimiento de las enzimas de
restricción?
c) ¿Qué tipos de corte pueden producir y qué nombres reciben las terminaciones
formadas?
d) Además de ser útiles como “ tijeras moleculares” ¿qué otro uso se les da a las
endonucleasas de restricción?
2. VECTORES DE CLONADO
Existen vectores naturales tales como plásmidos o bacteriófagos que han sido
modificados artificialmente para poder ser utilizados en el clonado.Otros han sido
construidos por el hombre como los cósmidos, cromosomas artificiales de levadura
(YACs) y los cromosomas artificiales de mamíferos (MACs). Los vectores empleados
más frecuentemente comparten las siguientes propiedades:
1. Molécula pequeña, bien caracterizada.
2. Origen de replicación en la molécula que permita su propia reproducción así como
también la del fragmento insertado.
3. Fácil recuperación de la molécula híbrida.
Ejercicio 3
a) ¿Qué son los plásmidos y qué características naturales poseen?
b) Los plásmidos naturales han sido modificados para hacerlos más adecuados como
vectores de clonado. Observa la estructura del pBR322 y deduce qué condiciones debe
reunir un plásmido para que sirva como vector.

c) Volvamos nuevamente a la figura donde se muestra el clonado en plásmidos y
supone que el vector usado fue el pBR322. Las moléculas de pBR322 circular
purificadas deben ser cortadas con una enzima de restricción para insertar un
fragmento de ADN extraño ¿Qué enzima usarías y por qué?.
d) ¿Con qué enzima cortarías el ADN fuente? ¿ Por qué?
e) ¿Cómo ligarías los pBR322s con los fragmentos del ADN fuente? ¿Cómo evitarías
que los plásmidos recircularicen sin incorporar un inserto?
f) ¿Cómo se origina la molécula quimera cuando el ADN de interés es cortado con una
enzima diferente a la empleada para cortar el plásmido?
g) ¿Qué tamaño máximo de fragmentos puede ser clonado en plásmidos?
h) ¿Cómo se introducen las moléculas recombinantes en las bacterias hospedadoras?
i) ¿Cómo identificarías las colonias de bacterias que han incorporado los plásmidos con
inserto?
j)¿Qué es una biblioteca genómica o genoteca? ¿Cómo se construye?
Bacteriófagos: usaremos como ejemplo el Fago lambda por ser uno de los más
conocidos.
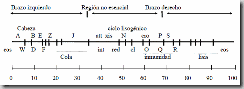
Figura. Mapa sintetizado del cromosoma lineal del bacteriófago lambda mostrando la
posición de algunos genes.
Ejercicio 4
a) ¿Qué son los sitios cos?
b) ¿Qué regiones del lambda pueden ser reemplazadas por ADN exógeno sin afectar
su capacidad de infectar bacterias?
c) ¿Cuál es el tamaño máximo de fragmentos que pueden ser insertados en el fago
lambda? ¿por qué?
d) ¿Qué ventajas ofrece clonar usando como vector un bacteriófago en lugar de un
plásmido?
Ejercicio 5
a) ¿Qué son los cósmidos?
b) Analiza las ventajas del clonado en cósmidos en relación con el clonado en los dos
vectores anteriores.
VECTORES DE EXPRESIÓN
El objetivo primario del clonado de genes para aplicaciones biotecnológicas es la
expresión del gen clonado en el hospedador seleccionado. Pero, la inserción de un gen
en un vector no necesariamente asegura que será expresado con éxito. La producción
de una proteína a partir de un gen requiere que el mismo sea transcripto
adecuadamente y que su mRNA sea traducido. En respuesta a esta necesidad se han
creado varios vectores de expresión especializados como el que se muestra a
continuación.

Figura. Esquema del vector de expresión pKK233-2. Ampr = gen de resistencia a la
amicilina.
ptac = promotor del operon lac. rbs = sitio de unión a los ribosomas . Noc I, Pst I y Hind
III = sitios de cortes para esas endonucleasas de restricción. T1 y T2 = secuencias
terminadoras de la transcripción.Ori 0 origen de replicación. La flecha indica la
dirección de la transcripción.
Ejercicio 6 Compara al pKK233-2 con el pBR322 ¿Qué similitudes y qué diferencias
observas?
TÉCNICAS DE RASTREO (SCREENING) POR HIBRIDACIÓN DEL ADN.
Una vez construida la biblioteca genómica, se puede localizar dentro de ella un
gen o bien algún segmento de ADN de interés. Se han diseñado numerosas técnicas
de sondeo: Hibridización Southern, hibridización Northern, hibridización Western entre
otras.
Ejercicio 7
a) ¿Qué es una sonda, qué tipos de sondas existen y para qué sirven?
b) Describe brevemente cada una de las técnicas de sondeo mencionadas arriba.
ADN COMPLEMENTARIO
Ejercicio 8
a) ¿A qué se denomina cADN o ADN copia y cómo se obtiene?
b) ¿Cómo se construye una biblioteca de cADN?
CLONADO POR PCR (REACCIÓN EN CADENA DE LA POLIMERASA)
El PCR es un procedimiento efectivo para obtener grandes cantidades de una
secuencia específica de ADN in vitro. Se puede obtener una amplificación de hasta
más de un millón de veces. Para que el PCR ocurra se necesita:
· Dos cebadores o primers (repasar transcripción del ADN) complementarios a
regiones sobre cadenas opuestas del ADN a ambos lados de la secuencia a
amplificar.
· Una ADN polimerasa termoestable que soporte temperaturas de 95ºC o más (Taq,
ADN polimerasa de Thermus aquaticus).
· Los cuatro desoxirribonucleótidos trifosfato.
Esta técnica consiste en alrededor de unos 30 ciclos de replicación del ADN. Cada ciclo
contiene 3 etapas:
1. Desnaturalización: 95ºC
2. Renaturalización: ~55ºC
3. Síntesis: ~75ºC
Ventajas del clonado por PCR.
· Rapidez: Una reacción típica de 30 ciclos de 3 a 5 min cada uno. El tiempo requerido
para el clonado en células es de semanas o meses.
· Sensibilidad de la reacción: Es posible amplificar secuencias a partir de diminutas
cantidades de ADN, aún de una única célula.
· No es necesario que el ADN esté muy purificado: Permite amplificar secuencias
específicas de material en el que el ADN está muy degradado o embebido en un
medio que hace problemático su aislamiento.
Ejercicio 9
a) Esquematiza una reacción en cadena de la polimerasa (PCR) hasta el cuarto ciclo.
No hay comentarios:
Publicar un comentario